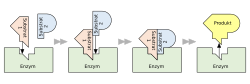
Schlüssel-Schloss-Prinzip
roter Kreis:Antigen (Epitop)
Das Schlüssel-Schloss-Prinzip beschreibt die Funktion von zwei oder mehreren komplementären Strukturen, die räumlich zueinander passen müssen, um eine bestimmte biochemische Funktion erfüllen zu können. Dieses Prinzip wurde 1894 von Emil Fischer hypothetisch beschrieben am Beispiel der spezifischen Bindung zwischen Enzym und Substrat.[1] Eine schwache, nicht-kovalente Wechselwirkung führt zu einem relativ stabilen Übergangszustand (Komplex) von Ligand (Gast) und Rezeptor (Wirt), dessen relative Bindungsstärke man als Affinität bezeichnet. Eine etwas zeitgemäßere Ausdrucksweise spricht vom Induced-fit-Konzept (Hand-im-Handschuh-Prinzip), um der konformativen Flexibilität chemischer Verbindungen Rechnung zu tragen. Oft ist es nur ein Teil der Gesamtstruktur des Liganden (vergleiche: Pharmakophor) bzw. des Rezeptors, der in die Komplexbildung einbezogen ist, der andere Teil mag funktionell irrelevant bleiben.
Beispiele
- Biochemie: Transmitter oder Modulatoren lösen am Rezeptor biochemische Prozesse aus, diese können auch durch z. B. Arzneistoffe oder Drogen exogen simuliert oder antagonisiert werden.
- Endokrinologie: Die Wechselwirkung zwischen den meist zellständigen Hormonrezeptoren und Hormonen lösen entsprechende Signalketten aus, die die Funktion der Zelle beeinflussen, wie auch ihre Differenzierung.
- Enzymologie: Ein Enzym erleichtert eine biochemische Reaktion, indem es die biogenen Reaktanten im Komplex zusammenführt. Obwohl die räumliche Struktur der Substratbindungsstellen des Enzyms genetisch festgelegt ist, kann es infolge der Substratbindung zu konformativen Strukturveränderungen im Enzym kommen, die die katalytische Effektivität erhöhen oder erst ermöglichen.
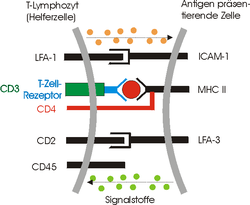
- Immunologie: Das komplexe gleichzeitige Zusammenspiel mehrerer komplementärer Strukturen an der Grenzfläche von Antigen-präsentierenden und Antigen-erkennenden Zellen bildet die Voraussetzung für die spezifische Antigenerkennung (bzw. genauer die Epitoperkennung). Für eine genauere Beschreibung siehe Antigenpräsentation.
Weiterhin zur Geltung kommt das Schlüssel-Schloss-Prinzip in folgenden Beispielen:
- Alle Zellen in Zellverbänden (Gewebe, Organe) besitzen an ihrer Zelloberfläche Strukturen und komplementäre Gegenstrukturen, die Teil der Kommunikation zwischen den Zellen sind und zum strukturellen und funktionellen Zusammenhalt beitragen.
- Voraussetzung für die Antigenerkennung ist die Kommunikation zwischen den Immunzellen über komplementäre Strukturen, um zwischen „Eigen“ und „Fremd“ zu unterscheiden.
- Immunzellen, die im Körper zirkulieren, benötigen Oberflächenstrukturen, um spezifisch von Ort zu Ort und zurück zu ihrem Ausgangsort (Homing) zu „finden“.
- Spermien müssen bestimmte Glykoproteine an der Oberfläche der Eizelle vorfinden, um in sie einzudringen.
- Viren benötigen spezifische komplementäre Strukturen („Andockstellen“), um ihren Wirt zu infizieren.
Viele diagnostische Nachweisverfahren beruhen auf dem Schlüssel-Schloss-Prinzip (z. B. Blutgruppendiagnostik, Gewebetypisierung, Infektionsdiagnostik, DNA-Diagnostik).
Einzelnachweise
- ↑ Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie und Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, S. 251–274, ISBN 3-8047-1485-4.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.08. 2025