Gravimetrie (Chemie)
Die Gravimetrie ist ein quantitatives Analyseverfahren, bei dem die Messung von Stoffmengen auf der Bestimmung der Masse (Auswaage) beruht. Dabei werden Fällungsanalyse, Elektrogravimetrie und Thermogravimetrie unterschieden.
Verfahren
Fällungsanalyse
Hierbei werden Ionen oder Moleküle in eine Fällungsform gebracht. Die gefällte Verbindung wird abfiltriert. Die Filtration kann entweder in einem Porzellanfiltertiegel bzw. Glasfiltertiegel erfolgen oder in einem Filterpapier (wobei spezielle aschefreie Filterpapiere zum Einsatz kommen). Anschließend wird der Filterkuchen gewaschen und getrocknet. Falls mit einem Papierfilter filtriert wurde, muss dieser noch verascht werden. In manchen Fällen wird für die Fällungsanalyse die Fällungsform durch Glühen in speziell hierfür vorgesehenen Öfen (Muffelöfen) in eine stöchiometrische Wägeform umgewandelt, womit die quantitative Bestimmung der Inhaltsstoffe erfolgen kann.
Mitunter sind Fällungs- und Wägeform identisch. Dies ist insbesondere dann der Fall, wenn der Niederschlag eine eindeutige Stöchiometrie aufweist und beispielsweise keine wechselnden Mengen von Kristallwasser gebunden werden: bei der Bestimmung von Sulfationen als Bariumsulfat, von Nickel mit Diacetyldioxim oder von Kalium mit Natriumtetraphenylborat. Ein Beispiel, bei dem die Fällungsform und die Wägeform nicht identisch sind, ist die unten aufgeführte Bestimmung von Eisen als Eisen(III)oxid.
Elektrogravimetrie
Die gesuchte Substanz wird bei der Elektrogravimetrie an einer Elektrode abgeschieden und anschließend gewogen.
Thermogravimetrie
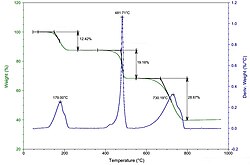
Bei thermogravimetrischen Analyseverfahren wird die Änderung der Stoffmasse in Abhängigkeit von der Temperatur untersucht.
Ein einfaches Beispiel dafür sind die gravimetrischen Methoden zur Bestimmung der Feuchte.
Durch diese Methode kann auch die Temperaturbeständigkeit von Materialien untersucht werden. Dazu wird die Probe erwärmt und die Massenänderung bestimmt. Speziell bei Kunststoffen kann so bestimmt werden, bis zu welchen maximalen Temperaturen sie eingesetzt werden können.
Beispiele
Bestimmung des Eisengehaltes einer Fe(III)-Salzlösung
Die Eisensalzlösung wird mit Ammoniakwasser versetzt, das ausfallende Hydroxid (Fällungsform) wird abfiltriert und anschließend durch Glühen bis zur Gewichtskonstanz in Eisen(III)oxid überführt. Die Masse des Oxids wird durch Auswägen auf der Analysenwaage bestimmt.
(Basische Reaktion von Ammoniak)
(Fällungsform)
(Wägeform)
Die gesuchte Masse a des zu bestimmenden Elementes (in unserem Beispiel Eisen) ist proportional der ausgewogenen Masse A der Wägeform (hier
).
Der Proportionalitätsfaktor
(Gravimetrischer Faktor) gibt an, zu welchem Anteil die Masse a in der
ausgewogenen Masse A enthalten ist.
Aus der ausgewogenen Masse
ergibt sich durch die Multiplikation mit einem Faktor
die Masse a des zu bestimmenden Elementes.
-
bzw.
.
-
enthält zum einen das Verhältnis der Molmassen des zu bestimmenden Elements,
,
zur Molmasse der Wägeform,
.
Zusätzlich muss
jedoch auch berücksichtigen, „wie oft“ sich eine Formeleinheit der gesuchten Substanz schließlich
pro Formeleinheit in der Wägeform wiederfindet. In diesem Beispiel finden sich 2 Eisenatome je Formeleinheit des Wägeproduktes wieder. Dies wird durch den
stöchiometrischen Koeffizient k, hier k=2, ausgedrückt:
wobei k der stöchiometrische Koeffizient,
die
Molekülmasse der gesuchten Substanz und
die Molekülmasse der Wägeform ist.
In unserem Beispiel nehmen wir an, wir haben 1,25 g Fe2O3 ausgewogen. Wie viel Eisen enthielt ursprünglich unsere Fe(III)-salzlösung?
Einsetzen von
ergibt:
a = m(Fe) = 0,874 g.
Das bedeutet, unsere Fe(III)-Salzlösung enthielt 874 mg Eisen.
Bestimmung von Sulfat
Die sulfathaltige Probelösung wird mit Salzsäure angesäuert. Unter Rühren wird eine 0.1 M Bariumchloridlösung eingetropft, bis sich am Eintropfpunkt kein Niederschlag mehr bildet. Der Niederschlag wird (zur Ostwaldreifung) auf einem Sandbad über Nacht getempert. Dabei bilden sich auf Kosten der kleinen Kristallite größere Kriställchen, die sich leichter abfiltrieren lassen. Der Niederschlag wird abfiltriert, mit Wasser und Ethanol gewaschen und getrocknet. Anschließend wird der Niederschlag bei 600 °C bis zur Gewichtskonstanz geglüht. Dies dauert im Regelfall nicht länger als 2–3 Stunden.
(Fällungs- und Wägeform)
Bestimmung von Nickel(II)
Die wässrige Nickel(II)-haltige Probelösung wird tropfenweise mit einer alkoholischen Lösung von Dimethylglyoxim versetzt, bis kein weiterer rötlicher Niederschlag mehr ausfällt. Dann wird das Ethanol verkocht. Anschließend filtriert man über eine Glasfritte ab. Nach waschen des Niederschlages trocknet man im Trockenschrank bis zur Massenkonstanz. Reaktionsgasgleichung, wobei Dimethylglyoxim mit H[DMG] abgekürzt wird:
Gravimetrische Methoden zur Feuchtemessung
Das am häufigsten verwendete Verfahren zur Messung des Wassergehalts von Materialproben ist die gravimetrische Methode (auch Darr-Wäge-Trocknung). Der Wassergehalt der Materialprobe wird dabei durch den Gewichtsverlust beim Trocknen bestimmt.
Die Materialprobe wird nach der Entnahme luftdicht verpackt und gewogen. Anschließend wird die Probe in einem Trockenofen bei ca. 105 °C getrocknet, bis sich Gewichtskonstanz bei aufeinanderfolgenden Wägungen einstellt. Die Trocknungsdauer und -temperatur ist materialabhängig und in entsprechenden Normen festgelegt. Bei der Trocknung darf kein chemisch gebundenes Wasser freigesetzt werden. Deshalb ist die Trocknungstemperatur von Gips nur 40 °C. Nach dem Trocknen wird die Materialprobe erneut gewogen. Aus der Differenz der Wägungen lässt sich der Wassergehalt der Materialprobe ermitteln.
Der gravimetrische Wassergehalt
ergibt sich aus
der Masse der feuchten Probe
und der Masse
der trockenen Probe
:
Vorteile
Die Vorgehensweise bei der Entnahme der Probe und der Trocknungsprozedur ist als Referenzmethode anerkannt. Viele andere Verfahren werden mit dieser Methode verglichen bzw. die indirekten Methoden kalibriert. Vorteile dieser Methode sind die relativ einfache Handhabung und die im Allgemeinen gute Genauigkeit.
Nachteile
Ein Nachteil des gravimetrischen Verfahrens ist, dass bei der Trocknung organischer Materialien chemische Umwandlungen durch Oxidationsprozesse einsetzen können. Diese können aufgrund der Sauerstoffentnahme die anschließende Wägung zu höheren Werten beeinflussen. Genauso kann es auch zu einer thermischen Zersetzung mit einem daraus resultierenden Gewichtsverlust kommen. So ist in kolloidhaltigen Böden wie Lehm oder Ton die vollständige Entfernung des eingelagerten Wassers nur unter Zerstörung der Kolloidstruktur möglich.
Aussicht
Die gravimetrische Methode ist für langfristig angelegte Feldmessungen nicht zu empfehlen. Für Labormessungen ist sie jedoch als Referenzverfahren etabliert. Die langen Trocknungszeiten können durch eine Schnelltrocknung mittels
- Infrarotstrahler,
- Elektroplatte,
- Gasbrenner oder
- Mikrowellenherd
abgekürzt werden.
Andere direkte Messverfahren zur Bestimmung des Wassergehalts in Böden haben sich nicht durchgesetzt. Dies liegt teilweise an der umständlichen Handhabung, dem erforderlichen Aufwand oder an der geringen Genauigkeit.
Quellen
- Klaus Kupfer u. a.: Materialfeuchtemessung: Grundlagen – Messverfahren – Applikationen – Normen. (= Kontakt & Studium. Band 513). Expert Verlag, 1997, ISBN 978-3-8169-1359-7.
- C. Hübner: Entwicklung hochfrequenter Meßverfahren zur Boden- und Schneefeuchtebestimmung. (= Wissenschaftliche Berichte. 6329). Forschungszentrum Karlsruhe, 1999,
DNB
 957821085.
957821085. - S. Völkner: Zum Einfluss räumlich begrenzter Diskontinuitäten auf die zeitabhängige Feuchteverteilung in Außenwänden. Dissertation. Ruhr-Universität Bochum, 2003.
- Sicherstellung der Nutzungsfähigkeit von Bauwerken mit Hilfe innovativer Bauwerksüberwachung. Technische Universität Braunschweig, Sonderforschungsbereich 477, 2000.
- U. Kaatze: Aspekte elektromagnetischer Aquametrie ionisch leitender Materialien. In: Technisches Messen. Ausgabe 5/2007, S. 261–267.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.06. 2024