
Chinone
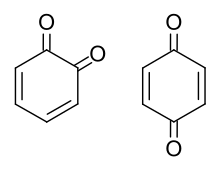
Chinone (englisch Quinones) sind eine Gruppe organischer Verbindungen, bei denen es sich um gekreuzt cyclisch konjugierte Diketone handelt. Sie sind Oxidationsprodukte von Dihydroxyaromaten. Die beiden einfachsten Vertreter sind 1,2- und 1,4-Benzochinon, die bei der Oxidation der beiden Dihydroxybenzole Brenzcatechin und Hydrochinon unter Aufhebung der Aromatizität des Ringes entstehen. 1,4-Benzochinon wird mitunter auch synonym als Chinon bezeichnet.
Eigenschaften
Der Name Chinon leitet sich von der Chinasäure ab, deren Oxidation u.a. zu 1,4-Benzochinon führt. Bei der Nomenklatur der Chinone geht man vom aromatischen Stammskelett aus (Benzo-, Naphtho-, Anthra-), stellt die Positionen der beiden chinoiden Carbonylgruppen im Molekül voran (z.B. 1,2-, 1,4-) und endet mit „chinon“ (Beispiele: 1,4-Benzochinon, 1,2-Naphthochinon, 9,10-Anthrachinon). Verbindungen, deren chemische Struktur ein Chinon-Element enthält, nennt man chinoid, das Strukturelement selbst chinoides System. Die Reduktion von Chinonen liefert die zugehörigen Hydroxyaromaten, die auch Chinole genannt werden.
Die durchweg farbigen Chinone sind Oxidationsmittel, deren Redoxpotential durch Substituenten (Halogen-, Cyano-, Alkyl-, Hydroxy-Gruppen etc.) deutlich verändert wird. Man unterscheidet zwischen 1,2-(ortho-)Chinonen (z.B. Pyrrolochinolinchinon) und 1,4-(para-)Chinonen (z.B. Anthrachinon).
Formaler Ersatz des Sauerstoffs einer chinoiden Carbonyl-Gruppe durch =NH, =NOH, =N2 oder =CH2 führt zu Chinoniminen, Chinonoximen, Chinondiaziden und Chinonmethiden.
Unter den Chinonen finden sich viele Gifte, aber auch ein breites Spektrum lebensnotwendiger Vitalstoffe, z.B. Ubichinon-10 (Coenzym Q10), Vitamin K und Pyrrolochinolinchinon.
Der Grundkörper Chinon wurde zuerst 1838 von dem russischen Liebig-Schüler Alexander Abramowitsch Woskressenski synthetisiert.
Vorkommen
In der Natur kommen Chinone besonders häufig in Farbstoffen vor, z.B. in Pilzen, Bakterien oder Blüten. Chinoide Systeme findet man auch in verschiedenen Antibiotika. Unter anderem entstehen Chinone durch enzymatische Oxidation von Polyphenolen. So spielen sie beispielsweise bei der Braunfärbung angeschnittener Äpfel eine wichtige Rolle.
Bekannte Chinone sind:
- Plastochinone bei der Photosynthese
- Ubichinone als Elektronenüberträger in der Atmungskette
- K-Vitamine (Phyllochinon, Menachinon)
Chinone werden auch in den Wehrsekreten von Insekten gefunden, vor allem Benzo- und Toluchinone.
Darstellung
Chinone bilden sich u.a. durch Oxidation von Phenolen oder polycyclischen aromatischen Kohlenwasserstoffen. Dabei erweisen sich besonders Cer(IV)-Verbindungen wie Ammoniumcer(IV)-nitrat als nützlich.
Redoxaktive und reaktive o-Chinone lassen sich durch die Umsetzung von trans-Dihydrodiolen mithilfe des Enzyms AKR1A1 biosynthetisch herstellen.
Reaktionen
Synthetisch wichtig sind die (gegebenenfalls photochemisch ausgelösten) Cycloadditions-Reaktionen der Chinone, die zu Cyclobutan-Derivaten, Oxetanen, Käfigverbindungen und Pyranen führen können. Olefine addieren sich z.B. bei Belichtung an das 1,2-Dicarbonyl-System von ortho-Chinonen, das in diesen Fällen als Hetero-1,3-dien-System fungiert (siehe Diels-Alder-Reaktion). Dies geschieht unter anderem unter Bildung von Dioxan-Derivaten (Schönberg-Reaktion).
Das im Gegensatz zu den Reinsubstanzen tieffarbige 1:1-Gemisch von 1,4-Hydrochinon und 1,4-Benzochinon nennt man Chinhydron, ein klassisches Beispiel für einen Charge-Transfer-Komplex.
Semichinone
Die Reduktion von Chinonen zu Chinolen geschieht mehrstufig über reaktive radikalische Zwischenverbindungen, die Semichinone.
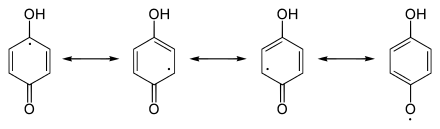 Mesomere Grenzstrukturen von Semichinon
Mesomere Grenzstrukturen von Semichinon
Dabei sind die Reduktionsvorgänge mit Säure-Basen-Gleichgewichte gekoppelt. Diese sind z.T. recht beständig, wie die Semichinone der Ubichinone. Die Reduktion des Chinons mit der Bildung eines Semichinons und dessen weiterführende Reduktion zum Hydrochinon sei am Beispiel von 1,4-Benzochinon erläutert:
Aus dem 1,4-Benzochinon 1 entsteht nach Protonierung und Reduktion das Semichinon 2. Das ungepaarte Elektron ist dabei über das semichinoide System verteilt. Die weitere Reduktion nebst Protonierung führt zum Hydrochinon 3.
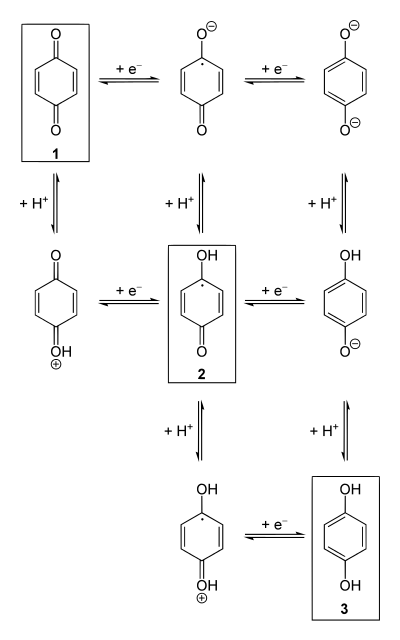 Redoxgleichgewichte (horizontal) sowie Säure-Basen-Gleichgewichte (vertikal) für Chinon
Redoxgleichgewichte (horizontal) sowie Säure-Basen-Gleichgewichte (vertikal) für Chinon
am Beispiel von 1,4-Benzochinon.
Verwendung
Chinone finden als Oxidationsmittel, Bakterizide und analytische Reagenzien Verwendung. Sie entstehen auch als Zwischenprodukt bei Farbstoffsynthesen. Auch in Malariamedikamenten spielen Chinone eine wichtige Rolle. In der technischen Chemie sind sie vor allem zur Gewinnung von Wasserstoffperoxid über Anthrachinon wichtig.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.01. 2026