
Guanidine
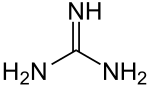
Guanidine sind eine Stoffgruppe der organischen Chemie, die sich vom Grundkörper Guanidin ableitet. Dieses besteht aus einem Kohlenstoffatom, an das zwei Aminogruppen (-NH2) sowie eine über eine Doppelbindung eine NH-Gruppe gebunden sind. Bei den anderen Vertretern sind ein oder mehrere Wasserstoffatome gegen andere Gruppen, beispielsweise organische Reste, substituiert.
Vorkommen

Guanidine sind in der Natur verbreitet und nehmen wichtige biologische Funktionen ein. Prominente Vertreter sind die Nukleinbase Guanin, die Aminosäure Arginin und das Kreatin. Die biologische Bedeutung der Stammverbindung ist Stand 2021 jedoch wenig erforscht.[1]
Die Aminosäure Canavanin ist strukturell eng mit Arginin verwandt, allerdings ist eine CH2-Gruppe gegen ein Sauerstoffatom ausgetauscht, über das die Guanidin-Gruppe an die Hauptkette gebunden ist. Canavanin ist ein pflanzlicher Abwehrstoff der beispielsweise insektizid wirkt, da er statt Arginin in Proteine eingebaut wird, was deren Funktion beeinträchtigt.[2] Canavanin kommt in Hülsenfrüchtlern (Leguminosae) vor, speziell der Unterfamilie Schmetterlingsblütler (Papilionoideae). Dazu gehören beispielsweise die gewöhnliche Robinie und verwandte Arten.[3] Das Galegin ist ein giftiges Guanidin, das beispielsweise in der Geißraute vorkommt.[4]
Guanidineinheiten sind in verschiedenen Toxinen enthalten, beispielsweise Tetrodotoxin und Saxitoxin. Tetrodotoxin kommt in dem Kugelfisch Spheroides rubipres vor, sowie in dem Molch Taricha torosa und im Panama-Stummelfußfrosch (Atelopus zeteki) vor.[5] Diese Verbindungen blockieren spannungsabhängige Natriumkanäle. Die Wirkung beruht vermutlich darauf, dass die Guanidineinheiten in protonierter Form mit den Ionenkanälen interagieren können, analog zu Natriumionen. Durch ihre Größe können sie die Kanäle jedoch nicht passieren, was zur Blockade führt.[6]
Herstellung
Guanidine können aus Thioharnstoff oder substituierten Derivaten hergestellt werden. Hierzu wird zunächst das Schwefelatom mittels Wasserstoffperoxid zur Sulfinsäure oder Sulfonsäure oxidiert. Anschließend kann es durch ein Amin substituiert werden, wodurch ein Guanidin entsteht.[7]
Verwendung
Das Nitroguanidin dient als wenig brisanter Sprengstoff unter anderem als Treibladung für Schusswaffen und Auto-Airbags.[8] Das Biguanid, das formal durch Kondensation zweier Moleküle Guanidin entsteht, kommt als Teilstruktur in vielen Pharmazeutika vor. Dazu gehören die Antiseptika Polyhexanid und Chlorhexidin. Chlorhexidin wird in der Chirurgie verwendet, zur Behandlung von Brandwunden und in der Zahnmedizin, beispielsweise zur Behandlung der Parodontitis.[9] Das Metformin, eines der meistgenutzten Antidiabetika, und einige verwandte Pharmazeutika sind ebenfalls Biguanide.[10]
Einzelnachweise
- ↑ Ronald R. Breaker, Ruben M. Atilho, Sarah N. Malkowski, James W. Nelson, Madeline E. Sherlock:
The Biology of Free Guanidine As Revealed by Riboswitches. In: Biochemistry.
Band 56,
Nr. 2, 17. Januar 2017,
S. 345–347,
doi:
 10.1021/acs.biochem.6b01269,
10.1021/acs.biochem.6b01269,
 PMID 28060483,
PMID 28060483,
 PMC 5315402 (freier Volltext).
PMC 5315402 (freier Volltext).
- ↑ Gerald A. Rosenthal: The biochemical basis for the deleterious effects
of l-canavanine. In: Phytochemistry.
Band 30,
Nr. 4, Januar 1991,
S. 1055–1058,
doi:
 10.1016/S0031-9422(00)95170-7.
10.1016/S0031-9422(00)95170-7.
- ↑ Matt Lavin: The occurrence of canavanine in seeds of the tribe robinieae. In:
Biochemical Systematics and Ecology. Band 14,
Nr. 1, Januar 1986,
S. 71–73,
doi:
 10.1016/0305-1978(86)90087-6.
10.1016/0305-1978(86)90087-6.
- ↑ George Barger, Frank David White: The Constitution of Galegine. In:
Biochemical Journal. Band 17,
Nr. 6, 1. Januar 1923,
S. 827–835,
doi:
 10.1042/bj0170827,
10.1042/bj0170827,
 PMID 16743219,
PMID 16743219,
 PMC 1259583 (freier Volltext).
PMC 1259583 (freier Volltext).
- ↑ Yong H. Kim, George B. Brown, Harry S. Mosher, Frederick A. Fuhrman: Tetrodotoxin:
Occurrence in Atelopid Frogs of Costa Rica. In: Science.
Band 189,
Nr. 4197, 11. Juli 1975,
S. 151–152,
doi:
 10.1126/science.1138374.
10.1126/science.1138374.
- ↑ B. Hille: The receptor for tetrodotoxin and saxitoxin. A structural hypothesis.
In: Biophysical Journal. Band 15,
Nr. 6, Juni 1975,
S. 615–619,
doi:
 10.1016/S0006-3495(75)85842-5,
10.1016/S0006-3495(75)85842-5,
 PMID 1148362,
PMID 1148362,
 PMC 1334742 (freier Volltext).
PMC 1334742 (freier Volltext).
- ↑ Cynthia A. Maryanoff, Robin C. Stanzione, James N. Plampin, John E. Mills: A
convenient synthesis of guanidines from thioureas. In: The Journal of Organic Chemistry.
Band 51,
Nr. 10, Mai 1986,
S. 1882–1884,
doi:
 10.1021/jo00360a040.
10.1021/jo00360a040.
- ↑ Ernst‐Christian Koch: Insensitive High Explosives: III. Nitroguanidine – Synthesis –
Structure – Spectroscopy – Sensitiveness. In: Propellants, Explosives, Pyrotechnics.
Band 44,
Nr. 3, März 2019,
S. 267–292,
doi:
 10.1002/prep.201800253.
10.1002/prep.201800253.
- ↑ Jean-Marie Lachapelle: A comparison of the irritant and allergenic properties of
antiseptics. In: European Journal of Dermatology.
Band 24,
Nr. 1, Januar 2014,
S. 3–9,
doi:
 10.1684/ejd.2013.2198.
10.1684/ejd.2013.2198.
- ↑ Scott A. Gabel, Michael R. Duff, Lars C. Pedersen, Eugene F. DeRose, Juno M. Krahn, Elizabeth E. Howell,
Robert E. London: A Structural Basis for Biguanide Activity. In: Biochemistry.
Band 56,
Nr. 36, 12. September 2017,
S. 4786–4798,
doi:
 10.1021/acs.biochem.7b00619,
10.1021/acs.biochem.7b00619,
 PMID 28766937,
PMID 28766937,
 PMC 5740485 (freier Volltext).
PMC 5740485 (freier Volltext).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.11. 2024