
Estrogene
Estrogene oder Östrogene (als „oestrus“-erzeugende Substanzen von altgriechisch οἶστρος oístrŏs, latinisiert oestrus „Stachel“, „Leidenschaft“ und lateinisch gignere „erzeugen“), auch Follikelhormone genannt, sind die wichtigsten weiblichen Sexualhormone aus der Klasse der Steroidhormone. Es sind Verbindungen, die im Tierexperiment beispielsweise bei kastrierten Nagetieren Brunsterscheinungen hervorrufen.
Sie werden hauptsächlich in den Eierstöcken (Ovarien) in Follikeln und im Gelbkörper, zu einem geringeren Teil auch in der Nebennierenrinde, produziert. Während der Schwangerschaft werden die Estrogene auch in der Plazenta und vom Fetus gebildet. Auch Männer produzieren im Hoden kleine Mengen an Estrogenen; zudem wird ein gewisser Teil des Testosterons im Fettgewebe durch ein Enzym, die sogenannte Aromatase, in Estrogene umgewandelt. Die Regulierung der Menge der in den Gonaden produzierten Östrogene erfolgt durch von der Hypophyse gebildete in die Blutbahn ausgeschüttete Steuerungshormone.
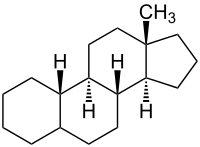
(13β-Methyl-gonan).
Estrogene sind Steroide, die als Grundgerüst Estran (13β-Methyl-gonan) besitzen. Die erstmalige Isolierung von Estrogenen und die Bestimmung der Struktur von Estrogenen erfolgte 1929 durch den deutschen Chemiker Adolf Butenandt.
Biosynthese
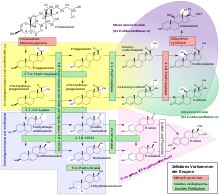
Estrogene entstehen durch die Umwandlung von männlichen Geschlechtshormonen. Hauptsächlich entsteht Estradiol durch Umwandlung von Testosteron. Die Umwandlung wird durch das Enzym Aromatase katalysiert. Dabei wird der Ring A mit den C-Atomen 1 bis 5 und 10 des Sterangerüstes in eine aromatische Struktur (siehe Aromat) umgewandelt.
Wirkung
Estrogene fördern die Reifung einer befruchtungsfähigen Eizelle. Durch Estrogene wird die Gebärmutterschleimhaut gut durchblutet, der Muttermund öffnet sich, und das Gebärmutterhalssekret wird durchlässig für Spermien. Estrogene signalisieren der Hypophyse die Eizellreife und lösen damit indirekt den Eisprung aus. Die Konzentration der Estrogene ändert sich erheblich im Verlauf des weiblichen Zyklus. Gesteuert wird die Produktion von der Hypophyse über die Gonadotropine (FSH und LH). Nach der Menopause fällt die Estrogensynthese im weiblichen Körper stark ab.
Im Blut werden Estrogene meist an Eiweiß gebunden transportiert. An bestimmten Organen (z.B. der weiblichen Brust und der Gebärmutter) befinden sich spezifische Estrogenrezeptoren, an die sich die Estrogene binden. Die Estrogene werden direkt zum Zellkern transportiert und beeinflussen so die Aktivität der Zellen. Der synthetische Estrogenabkömmling Ethinylestradiol war in der ersten in Europa erhältlichen Antibabypille (Anovlar) enthalten und wurde zu einer tragenden Säule des Pharmaunternehmens Schering AG. Es ist noch heute die estrogene Komponente in vielen hormonellen Empfängnisverhütungsmitteln.
Estrogene fördern das Wachstum von Vagina (Scheide), Gebärmutter, Eierstock und Eileiter sowie die Ausbildung sekundärer weiblicher Geschlechtsmerkmale wie der Brüste.
Estrogene wirken physiologisch auf die Knochen in Form eines Epiphysenschlusses und Hemmung der osteoklastären Knochenresorption; eine Verminderung des Estrogenspiegels im Blut kann zu Osteoporose (Knochenschwund) führen. Estrogene haben auch eine stimulierende Wirkung auf das Immunsystem, weswegen Estrogentherapien gelegentlich als Nebenwirkung die Aktivierung latenter Autoimmunerkrankungen haben. Zudem erhöhen Estrogene im Hirn die Sensibilität für das Hören; ein verminderter Estrogenspiegel, etwa nach der Menopause, verschlechtert dagegen das Hörvermögen. Das Hormon ist essentiell für das Speichern von Gedächtnisinhalten von Geräuschen und Sprache.
Bei einigen Tieren wie Fischen und Fröschen wurden unter Einfluss von Estrogenen und Halogenkohlenwasserstoffen künstliche Geschlechtsumwandlungen beobachtet.
Arten von Estrogenen
Von den natürlichen Estrogenen zeigen lediglich Estriol und – in hoher Dosierung – Estradiol bei oraler Anwendung eine Wirkung. Wegen schneller Metabolisierung besitzen Estradiol und andere natürliche Estrogene bei parenteraler Applikation eine flüchtige und bei oraler Applikation nur geringe Wirkung. Aus diesem Grunde werden vorwiegend künstliche Estrogene medikamentös eingesetzt, die meist als Ester der natürlichen Verbindungen oder als substituierte Derivate wesentlich langsamer metabolisiert werden und damit länger wirksam sind. Eine natürliche oder künstlich hergestellte Estrogenform, die zur Symptombehandlung bei der Menopause (Hitzewallungen, Scheidenveränderungen, Knochenschwund) oder zur Behandlung einer ausbleibenden Ovulation einsetzbar ist und zur Beschwerdelinderung in fortgeschrittenen Stadien von Prostata- und Brustkrebs verwendet wurde, wird als (mit Schwefel- oder Glukuronsäure) gekoppeltes Estrogen bzw. konjugiertes Estrogen bezeichnet.
Natürliche Estrogene
| • Estron (E1) |
| • Estradiol (E2) |
| • Estriol (E3) |
| • Estetrol (E4) |
| • Pferdeestrogene (lat. equus = Pferd): Equol, Equilin, Equilenin |
-
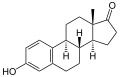 Estron (E1)
Estron (E1) -
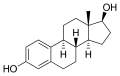 Estradiol (E2)
Estradiol (E2) -
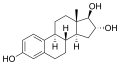 Estriol (E3)
Estriol (E3) -
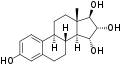 Estetrol (E4)
Estetrol (E4) -
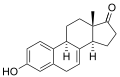 Equilin
Equilin -
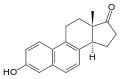 Equilenin
Equilenin
Synthetische Estrogene mit 17α-Ethinylgruppe
| • |
Ethinylestradiol |
| • |
Mestranol |
| • |
11β-Methyl-ethinylestradiol |
| • |
Turisteron |
| • |
Moxestrol (11β-Methoxy-ethinylestradiol) |
Sonstige Estrogene
| • |
6-Dehydroestron |
| • |
17-Desoxyestradiol |
| • |
2-Hydroxyestradiol |
| • |
Isoestradiol (8α-Estradiol) |
| • 1818-12-8 : | 2-Methylestradiol |
| • 6171-48-8 : | 4-Methylestradiol |
| • |
Polyestradiol-phosphat |
| • |
Promestrien |
| • 88847-87-4 : | 2-Chloroestradiol |
| • 126559-87-3 : | 1,11β-Ethanoestradiol |
Nicht-steroidale Estrogene
| • |
C18H20O2 : Diethylstilbestrol |
| • |
C18H18O2 : Dienestrol |
| • |
C20H24O2 : Dimestrol |
| • |
C23H21ClO3 : Chlorotrianisen |
| • |
C25H26O2 : Stilbestrol-monobenzyl-ether |
| • |
C18H22O8P2 : Fosfestrol |
| • 22059-16-1 : | C19H26O2 : Homoestradiol (Grundgerüst ist Perhydrochrysen anstatt Steran) |
| Fusarientoxine mit estrogener Wirkung: | |
| • |
C18H22O5 : Zearalenon |
| • |
C18H26O5 : Zeranol |
Metabolismus
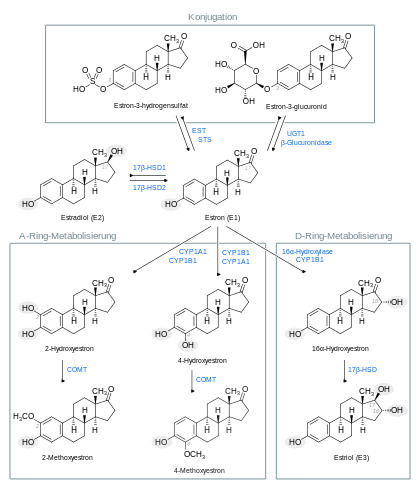
Reversible Reaktionen
Die im Stoffwechsel gebildeten humanen C-18-Steroidhormone Estron und Estradiol werden durch 17β-Hydroxysteroiddehydrogenasen (17β-HSD), die in verschiedenen Organen und Geweben vorkommen, gegenseitig ineinander umgewandelt.
Über Phase-II-Stoffwechselreaktionen (Konjugationen) entstehen aus Estrogenen wasserlösliche Estrogenkonjugate (Hydrogensulfate und Glucuronide), die leicht renal filtriert oder biliär (d. h. über die Galle) sezerniert werden. Die Konjugation kann an hydroxyltragenden Positionen wie zum Beispiel C-3, C-16α und/oder C-17β erfolgen. Die gebildeten Konjugate sind selber unwirksam, dienen aber andererseits als Reservoir, aus denen die biologisch wirksamen Formen unter Beteiligung entsprechender Enzyme zurückgewonnen werden können. Estron und Estradiol unterliegen über ihre Glucuronidkonjugate einem ausgeprägten enterohepatischen Kreislauf. Auch der Phase-I-Metabolit Estriol wird konjugiert; sein Doppelkonjugat Estriol-3-hydrogensulfat-16α-glucuronid (E3-3S-16G) ist der hauptsächlich vorkommende Estrogenmetabolit in der Galle. Estron-3-hydrogensulfat (E1-S) ist die Hauptkomponente der als Arzneistoff eingesetzten Konjugierten Estrogene
Irreversible Reaktionen
Bei den beiden irreversiblen Hauptwegen unterscheidet man zwischen Metabolisierungen am Ring A und am Ring D:
- Über Cytochrom-P450-Enzyme (CYP) katalysierte Hydroxylierungsreaktionen am C-2 oder C-4 des A-Ringes entstehen Verbindungen, die über ihre Brenzcatechinstruktur Ähnlichkeiten mit den Catecholaminen aufweisen und Catecholestrogene genannt werden. Sie vermögen in den Stoffwechsel von Catecholaminen wie bspw. Dopamin und Noradrenalin einzugreifen. Mittels Catechol-O-Methyltransferasen (COMT) werden sie in die Methoxymetaboliten umgewandelt.
- Bei der Ring-D-Metabolisierung wird durch Hydroxylierung am C-16α zunächst 16α-Hydroxyestron gebildet und im Weiteren das Estriol, das eine leichte und kurzzeitige estrogene Wirkung hat. Es wird nicht wieder in Estradiol umgewandelt, sondern umfassend konjugiert. In geringem Umfang werden auch epi-Estriole (16α,17α und 16β,17β) gebildet.
Darüber hinaus werden Estradiol, Estron und Estriol in geringem Ausmaß auch in Positionen der beiden anderen Ringe (Ringe B und C) oxidiert und hydroxyliert.
Equine und synthetische Estrogene
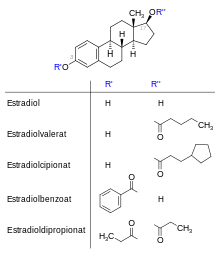
Vergleichbare Metabolisierungsreaktionen wie bei den humanen finden auch bei den equinen Estrogenen (Pferdeestrogene) statt. Equine Estrogene (Equilin, Equilenin, Δ8-Estron) zeichnen sich durch ungesättigte Bindungen im Ring B aus, die bei den humanen Estrogenen nicht vorkommen.
Durch Veresterung des Estradiols oder Einführung zusätzlicher Substituenten erhält man Abkömmlinge, die sich nur wenig in der Pharmakodynamik, jedoch deutlich in der Pharmakokinetik unterscheiden und arzneilich genutzt werden. Durch Veresterung an der 17β-Hydroxygruppe (Estradiolcipionat, Estradiolvalerat) wird die Umwandlung von Estradiol in das weniger wirksame Estron unterdrückt, solange die Hydrolyse noch nicht stattgefunden hat. Auch Estradiol-3-ester wie Estradiolbenzoat oder der Estradiol-3,17β-diester Estradioldipropionat haben eine verlängerte Wirksamkeit. Da die Ester wenig polar sind, eignen sie sich zur Herstellung von intramuskulären Depotformen, wodurch ebenfalls eine längere Wirkdauer resultiert. Die Einführung einer Ethinylgruppe am C-17 (Ethinylestradiol, Mestranol) ist irreversibel. Sie verhindert eine rasche Inaktivierung in der Leber.
Hyperandrogenismus
Etwa fünf bis zehn Prozent aller Frauen leiden unter den Folgen einer Ungleichverteilung männlicher und weiblicher Hormone, die mit eine Ursache des sogenannten polyzystischen Ovarsyndrom PCOS ist.
Literatur
- Lois Jovanovic, Genell J. Subak-Sharpe: Hormone. Das medizinische Handbuch für Frauen. (Originalausgabe: Hormones. The Woman’s Answerbook. Atheneum, New York 1987) Aus dem Amerikanischen von Margaret Auer, Kabel, Hamburg 1989, ISBN 3-8225-0100-X.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.11. 2025