
Absorptionsspektrum

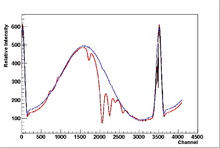
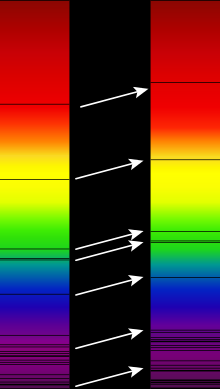
Ein Absorptions- oder Absorptionslinienspektrum ist ein Farb-
bzw. elektromagnetisches
Spektrum, das dunkle Spektrallinien
enthält. Es entsteht, wenn breitbandiges (weißes) Licht
Materie durchstrahlt und Lichtquanten (Photonen)
bestimmter Wellenlängen oder Wellenlängenbereiche dabei absorbiert werden
(Resonanzabsorption).
Die absorbierten Photonen fehlen im hindurchtretenden Licht, weshalb das
Spektrum bei den betreffenden Wellenlängen dunkel oder im Extremfall schwarz
ist.
Diese dunklen Absorptionslinien
werden im Sonnenspektrum nach ihrem Entdecker Fraunhoferlinien
genannt, sind aber auch im Spektrum von Sternen
und vielen anderen Himmelskörpern nachweisbar.
Werden die Photonen absorbiert, indem sie Atome anregen, handelt es sich um scharf definierte Energiebeträge und damit Wellenlängen, und die dunklen Bereiche sind dementsprechend schmale Linien. In Molekülen liegen dagegen oft viele absorbierbare Energiewerte dicht beieinander und bilden im Spektrum breitere dunkle Bereiche, sogenannte Absorptionsbanden. In jedem Fall ist das beobachtete Absorptionsspektrum charakteristisch für die Art der Materie, die die Strahlung durchquert. Deshalb ist die Spektroskopie in verschiedenen Wellenlängenbereichen, auch mit ultraviolettem oder infrarotem Licht, eine wichtige Methode zur Analyse von Stoffen.
Werden freie Atome (z.B. Gas oder Dampf) spektroskopiert, so werden die Photonen nach der Absorption wieder emittiert, und zwar gleichförmig in alle Raumrichtungen. Wird das Licht nur aus einer Richtung eingestrahlt, so findet man im hindurchgetretenen Licht das für die Atomsorte (chemisches Element) typische Absorptionsspektrum als Linienspektrum. Das in die anderen Raumrichtungen gestreute Licht zeigt das entsprechende Emissionsspektrum.
Bei der Spektroskopie von Festkörpern kann zwischen der Absorption und eventueller Emission noch eine Relaxation im Festkörper auftreten. Dabei wird ein Teil der Energie der Photonen z.B. in Wärme umgesetzt. In diesem Fall sind Absorptions- und Emissionsspektrum nicht wie bei den freien Atomen komplementär zueinander. Bei "Verbotener Übergang" href="https://de.wikipedia.org/wiki/Verbotener_%C3%9Cbergang">-->„verbotenen Linien“ ist es extrem unwahrscheinlich, dass Absorption beobachtet werden kann.
Anwendung
Anwendung finden Absorptionsspektren auch in der (Umwelt-)Mess- und Analysetechnik: Mit Hilfe eines FTIR-Spektrometers kann beispielsweise die Zusammensetzung eines Gasgemisches (z.B. Luft) quantitativ und qualitativ untersucht werden. Anhand des für jedes Gas charakteristischen Absorptionsspektrums („wie ein Fingerabdruck“) kann die Menge dieses Gases in dem gemessenen Gasgemisch ermittelt werden.
In der Atomabsorptionsspektrometrie wird das Absorptionsspektrum einer Probe erzeugt und gemessen. Auf diese Weise lässt sich die atomare Zusammensetzung der Probe bestimmen.
Eine große Bedeutung haben Absorptionsspektren in der Astronomie, da man durch sie die stoffliche Zusammensetzung und Temperatur leuchtender Himmelskörper ermitteln kann (siehe das Beispiel des Sonnenspektrums rechts). Ferner lassen sich durch den Zeeman-Effekt Magnetfelder und mittels Dopplereffekt Rotationen und radiale Geschwindigkeiten bestimmen. Die mit der Entfernung zunehmende Rotverschiebung von Galaxien war bereits in den 1930er-Jahren der erste Hinweis auf die Expansion des Weltalls.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.08. 2024