Cytoskelett
| Übergeordnet |
| Organell |
| Untergeordnet |
| Mikrofilamente Intermediärfilamente Mikrotubuli |
| Gene Ontology |
|---|
|
|
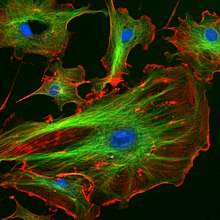
Das Cytoskelett (altgriechisch κύτος kýtos, deutsch ‚Zelle‘) (auch Zytoskelett oder Zellskelett) ist ein aus Proteinen aufgebautes Netzwerk im Cytoplasma eukaryotischer Zellen. Es besteht aus dynamisch auf- und abbaubaren, dünnen, fadenförmigen Zellstrukturen (Proteinfilamenten). Es ist verantwortlich für die mechanische Stabilisierung der Zelle und ihre äußere Form, für aktive Bewegungen der Zelle als Ganzes, sowie für Bewegungen und Transporte innerhalb der Zelle.
In fluoreszenzmikroskopischen Bildern mag das Zellskelett tatsächlich wie ein Skelett aussehen, der Name ist aber irreführend, weil es sich beim Cytoskelett nicht um ein steifes Skelett oder Gerüst handelt, sondern um ein dynamisches Geflecht von Strukturen. Man weiß inzwischen auch, dass Cytoskelettelemente nicht nur für die mechanische Stabilität, sondern auch für sensorische Funktionen wie die Signalübertragung zwischen Zellen unerlässlich sind.
Das Wort Cytoskelett wurde 1931 vom Embryologen Paul Wintrebert geprägt, der darüber spekulierte, wie es Eizellen gelingen könnte, ihre interne Organisation zu erhalten, wenn sie durch den engen weiblichen reproduktiven Trakt wandern müssen. Aus den starken auf die Eizelle einwirkenden Deformationskräften leitet Wintrebert die Notwendigkeit der Existenz eines Cytoskeletts („cytosquelette“) ab.
Das eukaryotische Cytoskelett
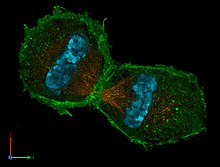
In der eukaryotischen Zelle unterscheidet man drei Klassen von Cytoskelettfilamenten, die jeweils von unterschiedlichen Proteinen beziehungsweise Proteinklassen gebildet werden, spezifische Begleitproteine besitzen und sich auf jeweils verschiedene Weise an den Aufgaben des Cytoskeletts beteiligen:
Alle drei Klassen sind an der mechanischen Stabilisierung der Zelle beteiligt. Oberflächendifferenzierungen werden durch Aktinfilamente und Mikrotubuli unterstützt. Auch alle Formen aktiver Bewegung erfolgen entlang dieser beiden Filamenttypen, da sie über spezifische Motorproteine verfügen.
Generell sind die Strukturen des Cytoskeletts mit für die Aufgabe und den Proteintyp spezifischen Begleitproteinen (u.a. Adaptorproteine und Motorproteine) assoziiert, die die Filamente stabilisieren, sich an ihnen bewegen oder sie mit anderen Strukturen verbinden (siehe beispielsweise Profilin). Der Auf- und Abbau des Cytoskeletts kann durch Cytoskelett-Inhibitoren gehemmt werden.
Mikrotubuli
Auffälligste Bestandteile des Cytoskeletts sind die Mikrotubuli, Hohlzylinder mit einem Durchmesser von 25 nm, die sich aus dem Protein Tubulin zusammensetzen. Intrazellulär sind sie mit ihren Motorproteinen Dynein und Kinesin für längere Transportvorgänge und die Bewegungen bzw. Befestigung der Organellen im Cytosol zuständig. Im Falle der Mitosespindel werden die replizierten Chromosomen an die beiden Kernpole gezogen. Mikrotubuli beteiligen sich nur wenig an der mechanischen Stabilisierung, sie stellen allerdings das charakteristische Binnengerüst der beweglichen Kinozilien.
Der Auf- und Abbau der Mikrotubuli kann sehr dynamisch durchgeführt werden und geht bei tierischen Zellen vom Zentrosom aus.
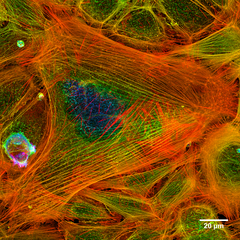
Aktinfilamente
Aktinfilamente (auch Mikrofilamente) sind Fasern mit 7 nm Durchmesser, die aus Aktin bestehen. Vor allem in netzartigen Anordnungen unterhalb der Plasmamembran und in Membranausbuchtungen (Mikrovilli, Pseudopodien) stabilisieren sie die äußere Form der Zelle, halten membranständige Proteine an ihrem Platz und ziehen in bestimmte Zelljunktionen ein (Adhärens-Kontakt). Auch sie können dynamisch auf- und abgebaut werden.
Die Motorproteine des Aktin bilden die Proteinklasse der Myosine. Auf der Aktin-Myosin-Interaktion basiert nicht nur die Bewegung der Muskulatur, sondern Myosine verspannen auch die Aktinfilamente zur Stabilisierung und sorgen für den Kurzstreckentransport zum Beispiel von Vesikeln zur Plasmamembran (während der Langstreckentransport von Mikrotubuli/Dynein und Kinesin übernommen wird).
Intermediärfilamente
Unter dem Begriff der Intermediärfilamente fasst man eine Reihe von Proteinfilamenten zusammen, die alle recht ähnliche Eigenschaften aufweisen. Ihr Durchmesser beträgt um die 10 nm (8 bis 11 nm), und sie können, da sie deutlich stabiler als Mikrotubuli und Aktinfilamente sind, am besten mechanische Zugkräfte aufnehmen. Aus diesem Grund dienen sie hauptsächlich der mechanischen Stabilisierung der Zellen. Sie bilden deren Stützgerüst und strahlen in bestimmte Zellverbindungen ein (Desmosomen, Hemidesmosomen).
Das prokaryotische Cytoskelett
Auch prokaryotische Zellen verfügen über Proteine, die als homolog zu den Proteinen aller drei eukaryotischen Proteinklassen angesehen werden. Auch wenn sie ähnliche Strukturen bilden, zeigen die Aminosäuresequenzen kaum Ähnlichkeiten zu den eukaryotischen Proteinklassen.
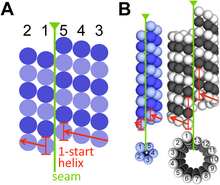
B – Modellvergleich bakterieller (blau) und eukaryoter (grau) Mikrotubuli. Zu den Eukaryoten zählen verschiedene einzellige Organismen sowie die mehrzelligen Tiere, Pflanzen und Pilze.
Während Eukaryoten, gleich ob es sich um einzellige oder mehrzellige wie Pflanzen, Pilze oder Tiere handelt, ein recht einheitliches Tubulin aufweisen (mit genetischer Ähnlichkeit von 90–95 %), haben Prokaryoten erheblich unterschiedlichere tubulinähnliche Proteine (BtubA und BtubB, TubZ, RepX, FtsZ), die teilweise nur zu 40 % in ihrer Gensequenz übereinstimmen. Trotzdem scheinen die aus diesen Homologen aufgebauten Mikrotubuli der Bakterien im Wesentlichen dieselben Funktionen zu erfüllen wie die der Eukaryoten.
Als Tubulin-Homolog wurde FtsZ gefunden, als Actin-Homolog FtsA. Diese Proteine sind insbesondere an Zellteilungsprozessen beteiligt. FtsZ-Proteine werden in Pflanzen von einer kleinen Genfamilie im Zellkern codiert. Sie werden zumeist in die Chloroplasten importiert, wo sie an der Teilung dieser Zellorganellen mitwirken. Aus Versuchen am Laubmoos Physcomitrella patens ist bekannt, dass FtsZ-Proteine auch ein komplexes Netzwerk in den Chloroplasten ausbilden können. Da dieses Netzwerk stark an das Cytoskelett erinnert, prägte Ralf Reski 2000 den Begriff des Plastoskeletts für diese Struktur und postulierte, dass sie ähnlich komplexe Funktionen in den Plastiden ausfüllt, wie das Cytoskelett für die gesamte Zelle. Zudem wurde im Bakterium Caulobacter crescentus das Crescentin gefunden, das in seiner Funktion den Intermediärfilamenten gleicht.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 31.03. 2025