Mizellen
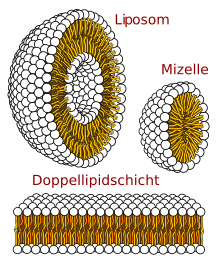
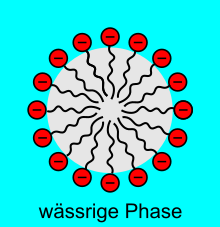
Mizellen oder Micellen (von lateinisch mica ‚Klümpchen‘, ‚kleiner Bissen‘), auch Assoziationskolloide genannt, sind zusammengelagerte Molekülkomplexe (Aggregate) aus amphiphilen Molekülen bzw. grenzflächenaktiven Substanzen.
Eigenschaften
In einem Dispersionsmedium (meist Wasser) binden sich die amphiphilen Moleküle aufgrund des hydrophoben Effekts aneinander. Dieser Vorgang wird Selbstassemblierung genannt. Mizellen bilden sich in polaren Lösungsmitteln wie Wasser ab einer bestimmten Massenkonzentration, der kritischen Mizellbildungskonzentration (CMC), aufgrund der Neigung der Tenside zur Phasentrennung. D.h., die hydrophilen Teile (Köpfe) der Tensidmoleküle richten sich zu den angrenzenden Wassermolekülen aus, wogegen die hydrophoben Teile (Schwänze) sich zusammenlagern und somit eine eigene Phase bilden (siehe Grafik). Eine solche Mizelle hat typischerweise eine Größe von wenigen Nanometern, z.B. ca. 4 nm für eine SDS-Mizelle in Wasser.
Inverse Mizellen
Auch in unpolaren Lösungsmitteln gibt es Mizellen, nur mit umgekehrter Orientierung (inverse Mizellen, auch reverse Mizellen genannt). Des Weiteren gibt es neben Kugeln viele andere geometrische Formen (Stäbchen, Plättchen etc.), je nach Größen- und Längenverhältnis von Kopf zu Schwanz.
Angewendet werden reverse Mizellen z.B. bei der Extraktion von Proteinen aus Fermentationsbrühen. Hierbei wird das Protein im Kern der reversen Mizelle gelöst.
Supermizellen
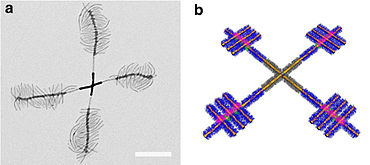
Supermizellen sind aus Mizellen aufgebaute hierarchische supramolekulare Strukturen.
Flüssigkristalle
Enthält eine Lösung sehr große Konzentrationen grenzflächenaktiver Substanzen, so können die vielen Mizellen höhere Ordnungszustände bilden, nämlich Flüssigkristalle.
Bildungsenergie
Der Mizellbildungsprozess läuft spontan ab, d.h. ihm liegt ein thermodynamisches
Gleichgewicht zugrunde. Die treibende Kraft dabei ist die Freisetzung von Wassermolekülen, die zuvor mit den Tensidmolekülen assoziiert waren, wodurch die
Entropie zunimmt. Die Mizellbildungsenthalpie
lässt sich wie folgt beschreiben:
mit
- Konstante
, variiert zwischen 1 und 2 je nach Ladung der Mizellen
- kritische Konzentration
zur Mizellbildung (engl. cmc, s.o.)
- Temperatur
in Kelvin
- universelle Gaskonstante
.
Molmasse
Der Zusammenhang der Molmasse M mit der CMC wird über die Debye-Gleichung beschrieben:
mit
- der optischen Konstante K (abhängig von Wellenlänge und Brechungsindex des Lösungsmittels und der Lösung)
- der Konzentration c des amphiphilen Moleküls
- der kritischen Mizellenkonzentration CMC
- der Turbidität
und
- dem zweiten osmotischen Virialkoeffizienten A2.
Weitere Bedeutung
Als Mizellenbildung wird auch das Zusammenklumpen von Asphaltenen in Mineralölprodukten bezeichnet, z.B. in Heizöl EL.
Literatur
- William M. Gelbart: Micelles, Membranes, Microemulsions, and Monolayers. Springer Science & Business Media, 2012, ISBN 978-1-4613-8389-5.
- Y. Moroi: Micelles. Springer Science & Business Media, 2013, ISBN 978-1-4899-0700-4.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.03. 2024