Entropie
| Physikalische Größe | |||||||
|---|---|---|---|---|---|---|---|
| Name | Entropie | ||||||
| Formelzeichen | |||||||
| |||||||
Die Entropie (Kunstwort altgriechisch ἐντροπία entropía, von ἐν en ‚an‘, ‚in‘ und τροπή tropḗ ‚Wendung‘) ist eine fundamentale thermodynamische Zustandsgröße mit der SI-Einheit Joule pro Kelvin (J/K).
Zufuhr von Wärme oder Materie bewirkt eine Zunahme der Entropie in einem System, ebenso alle spontan ablaufenden Prozesse innerhalb des Systems wie z.B. Vermischung, Wärmeleitung, chemische Reaktion oder Umwandlung von mechanischer in thermische Energie durch Reibung (siehe Dissipation, Energieentwertung). Abnehmen kann die Entropie eines Systems nur durch Abgabe von Wärme oder Materie. Daher kann in einem abgeschlossenen System (einem System, bei dem es keinen Energie- oder Materieaustausch mit der Umgebung gibt) die Entropie nicht abnehmen, sondern im Laufe der Zeit nur zunehmen (Zweiter Hauptsatz der Thermodynamik). Prozesse, bei denen die Entropie in einem System zunimmt, werden daher als irreversibel (unumkehrbar) bezeichnet. Sie können nur rückgängig gemacht werden, wenn ein anderes System die Entropie aufnimmt.
In der statistischen Mechanik ist der Makrozustand eines Systems um so wahrscheinlicher, je höher seine Entropie ist. Die Entropie eines durch makroskopische Größen definierten Systems (Makrozustand) wird durch die Zahl seiner zugänglichen, energetisch gleichwertigen Mikrozustände bestimmt – je höher diese Zahl, desto höher die Entropie des Makrozustands.
In einem sich selbst überlassenen System bewirken seine spontan ablaufenden inneren Vorgänge folglich im statistischen Mittel, dass es sich dem Makrozustand annähert, der bei gleicher Energie die höchstmögliche Entropie hat. Beispielsweise beobachten wir, dass sich ein System, bestehend aus einem kalten Metallbarren neben einem heißen Metallbarren in einer Isolierbox, d.h. in einem idealisierten abgeschlossenen System, thermisch angleicht, die Unterschiede verschwinden, beide Metallbarren werden nach einer gewissen Zeit gleich warm sein. Wir beobachten niemals das unwahrscheinliche spontane Abkühlen des einen Metallbarrens und das Erhitzen des anderen in einem solchen geschlossenen System.
Dies wird umgangssprachlich häufig dadurch umschrieben, dass Entropie ein „Maß für Unordnung“ sei. Allerdings ist Unordnung kein wohldefinierter physikalischer Begriff und hat daher auch kein physikalisches Maß. Richtiger ist es, die Entropie als ein objektives Maß für die Menge an Information zu begreifen, die benötigt würde, um von einem beobachtbaren Makrozustand auf den gerade vorliegenden Mikrozustand des Systems schließen zu können. Dies ist gemeint, wenn die Entropie auch als „Maß für die Unkenntnis der Zustände aller einzelnen Teilchen“ umschrieben wird.
Geschichtlicher Überblick
In der Geschichte der Physik gab es lange Zeit eine Auseinandersetzung über die Bedeutung des Wärmebegriffs: Die eine Seite vertrat die Theorie, dass die Wärmeerscheinungen allein in der vis viva („lebendige Kraft“ = kinetische Energie) der Atome begründet seien; die andere behauptete, dass die Wärme eine Substanz sei, der man den Namen Caloricum (französisch calorique, englisch caloric) gab.
Antoine Laurent de Lavoisier unterschied 1789 chaleur (Wärme) von calorique (Caloricum). Das Caloricum sollte unter anderem eine abstoßende Kraft zwischen den Atomen eines Festkörpers bewirken, so dass dieser bei Zufuhr einer ausreichenden Menge von Caloricum erst flüssig und dann gasförmig würde. Zusammen mit Pierre Simon Laplace konstruierte er ein Eiskalorimeter. Lavoisier und Laplace wollten sich aber nicht festlegen, ob die vis viva oder die Caloricum-Substanz die Ursache für die Wärmeerscheinungen ist. Joseph Black unterschied temperature von der quantity of heat, u.a. anhand der latenten Wärme beim Schmelzen. Er bemerkte, dass die Wärmemenge mit dem aus einem Kessel entweichenden Dampf mittransportiert werden müsse.
Benjamin Thompson, Reichsgraf von Rumford, untersuchte in seiner Münchner Zeit 1798 die Temperatur von Spänen, die beim Bohren von Kanonenrohren entstehen. Aufgrund der beliebig großen Wärmemenge, die dabei aus der mechanischen Bohrarbeit entstehen konnte, zweifelte er daran, dass das Caloricum eine (erhaltene) Substanz sein könnte, wodurch er den Vertretern der vis-viva-Theorie Auftrieb gab.
Der Namensgeber des Carnot-Prozesses, Nicolas Léonard Sadi Carnot, schrieb 1824, dass die Kraft einer Dampfmaschine nicht am Verbrauch von calorique liegt, sondern an ihrem Transport von einem warmen Körper auf einen kalten, und bereitete damit den Entropiebegriff vor. Mit den Experimenten von Robert Mayer und James Prescott Joule wurde Anfang der 1840er Jahre gezeigt, dass sich mechanische Arbeit quantitativ in Wärme umwandeln ließ. Dies war die Grundlage für den 1847 von Hermann von Helmholtz allgemein formulierten Energieerhaltungssatz, also den ersten Hauptsatz.
Weitere 20 Jahre später stellte Rudolf Clausius fest, dass bei einer Übertragung der Energieform Wärme auch eine andere mengenartige Größe fließen muss. Diese Größe sah er als die Ursache für die Disgregation beim Schmelzen an und nannte sie Entropie. Wie von Wilhelm Ostwald 1908 sowie Hugh Longbourne Callendar 1911 herausgearbeitet, entspricht die Entropie bei Clausius dem calorique bei Lavoisier und Carnot.
Mit Arbeiten von Ludwig
Boltzmann und Willard
Gibbs gelang es um 1875, der Entropie eine statistische
Definition zu geben, welche die zuvor makroskopisch definierte Größe
mikroskopisch erklärt.
Die Entropie
eines Makrozustands wird dabei
durch die Wahrscheinlichkeiten
der Mikrozustände
berechnet:
Der Proportionalitätsfaktor
ist die Boltzmannkonstante,
Boltzmann selbst hat ihren Wert jedoch nicht bestimmt.
Die so statistisch definierte Entropie kann in vielen Kontexten sinnvoll verwendet werden.
Zusammenhänge zwischen Entropie und Information ergaben sich schon im 19. Jahrhundert durch Diskussion über den Maxwellschen Dämon, ein Gedankenexperiment, das im Rahmen der Miniaturisierung im Computerzeitalter aktuell wurde. Die Informatik nutzt die Shannonsche Informationsentropie, die der statistischen Interpretation entspricht, als abstraktes Maß der Information ohne direkten Bezug zur physikalischen Realisation. Auch Norbert Wiener nutzte den Begriff der Entropie zur Beschreibung von Informationsphänomenen, allerdings mit unterschiedlichem Vorzeichen als Shannon. Dass sich die Konvention von Shannon durchgesetzt hat, ist vor allem der besseren technischen Verwertbarkeit seiner Arbeiten zuzuschreiben.
Klassische Thermodynamik
In der Thermodynamik kann ein System auf zwei Arten mit seiner Umgebung Energie austauschen: in Form von Wärme und Arbeit, wobei abhängig vom System und der Prozessführung verschiedene Varianten der Arbeit existieren, u.a. Volumenarbeit, chemische Arbeit und magnetische Arbeit. Im Zuge eines solchen Energieaustauschs ändert sich die Entropie sowohl des Systems als auch der Umgebung. Nur wenn die globale Summe der Entropieänderungen positiv ist, erfolgt die Änderung spontan.
Grundlagen
Die Entropie
(Einheit J/K) ist eine
extensive Zustandsgröße eines physikalischen Systems und verhält sich bei
Vereinigung mehrerer Systeme additiv wie auch das Volumen,
die Elektrische
Ladung oder die Stoffmenge.
Der Physiker Rudolf
Clausius führte diesen Begriff 1865 zur Beschreibung von Kreisprozessen ein.
Dividiert man
durch die Masse
des Systems, erhält man die spezifische Entropie
mit der Einheit J/(kg·K)
als intensive Zustandsgröße.
Das Differential
ist nach Clausius bei reversiblen
Vorgängen zwischen Zuständen im Gleichgewicht das Verhältnis von übertragener Wärme
und absoluter
Temperatur
:
Diese Entropieänderung ist bei Wärmezufuhr positiv, bei Wärmeabfuhr negativ.
In dieser Schreibweise wird ein nicht-kursives
benutzt, um hervorzuheben, dass es sich um ein vollständiges
Differential handelt, im Gegensatz zu
,
das kein vollständiges Differential sein kann, weil
eine Prozessgröße ist. In diesem Zusammenhang spielt also die reziproke absolute
Temperatur die Rolle eines „integrierenden Bewertungsfaktors“, der aus der
reversibel zu- oder abgeführten Wärme, einem – mathematisch gesehen –
unvollständigen Differential, ein zugehöriges vollständiges Differential
macht.[1]
Dadurch ist die Änderung der Entropie bei reversiblen Prozessen – im Gegensatz
zur zu- oder abgeführten Wärme – wegunabhängig. Mit der Festlegung eines
beliebigen Werts für einen Bezugszustand wird die Entropie damit zu einer allein
durch den jeweiligen Zustand gegebenen Zustandsgröße.
Insofern kann man die Entropie bei reversibler Prozessführung auch als die
„mit
bewertete Wärmeenergie“ definieren. Weiter unten wird das Problem behandelt, wie
weit die Energie eines Systems in Arbeit
umgewandelt werden kann.
Benutzt man den ersten Hauptsatz der Thermodynamik, ,
also dass die Energieänderung
sich zusammensetzt aus zugeführter Arbeit und Wärme, und setzt für die Arbeit
alle dem Experimentator mittels Änderung der Systemgrößen möglichen Prozesse,
erhält man aus (1) für die Änderung der Entropie als Funktion der
thermodynamischen Variablen (immer noch im reversiblen Fall)
Clausius behandelte auch irreversible Prozesse und zeigte, dass in einem isolierten thermodynamischen System die Entropie dabei nie abnehmen kann:
wobei das Gleichheitszeichen nur bei reversiblen Prozessen gilt.
ist die Entropieänderung des Systems mit
für die Entropie des Zustandes am Anfang der Zustandsänderung und
für den Zustand am Ende des Prozesses.
Aus (2) folgt für geschlossene Systeme, bei denen Wärmeenergie die Systemgrenzen passieren kann, die Ungleichung:
ist der Entropie-Anteil, der sich aus der Zufuhr von Wärme über die Systemgrenze
hinweg ergibt. Die Formel gilt auch für die Abfuhr von Wärme aus dem System, in
diesem Falle ist
negativ. Die Ungleichung (3a) wird nur für rein reversible Prozesse zu einer
Gleichung.
Bei der Analyse thermodynamischer Systeme in der Technik führt man oft eine Bilanzanalyse durch. Hierzu schreibt man die Ungleichung (3a) in der folgenden Form:
Dabei ist
der Entropieanteil der durch irreversible Vorgänge im Inneren des Systems
entsteht. Hierzu gehören etwa Vermischungsvorgänge nach dem Entfernen einer
inneren Trennwand, thermische Ausgleichsvorgänge, die Umwandlung von
elektrischer oder mechanischer Energie (Ohmscher Widerstand, Rührwerk) in Wärme
und chemische Reaktionen. Beschränken sich die irreversiblen Vorgänge
ausschließlich auf die Dissipation von mechanischer oder elektrischer Arbeit
,
dann kann
durch die Arbeit bzw. die dissipierte Leistung
ausgedrückt werden.
Läuft der irreversible Prozess quasistatisch ab, so dass das System immer nahe einem Gleichgewichtszustand ist, so kann (3) auch mit zeitlichen Ableitungen geschrieben werden.
Dabei wird
als Entropietransportstrom und
als Entropieproduktionsstrom bezeichnet.
Aus dem ersten Hauptsatz der Thermodynamik
folgt, dass das Produkt
den nicht verwerteten Anteil („Abwärme“) bei der isothermen
Erzeugung von Arbeit
aus vorhandener innerer
Energie
darstellt. Der Maximalwert dieser Arbeit ist die sogenannte Freie Energie
.
Dies ist eine äquivalente Form des 2. Hauptsatzes.
Eine Konsequenz dessen ist die Unmöglichkeit eines Perpetuum Mobile 2. Art. Clausius formulierte:
„Es existiert kein Kreisprozess, dessen einzige Wirkung darin besteht, Wärme von einem kälteren Reservoir zu einem wärmeren Reservoir zu transportieren.“
Offenbar hätte man sonst eine unerschöpfliche Energiequelle konstruiert. Wäre es nämlich möglich, einen solchen Kreisprozess zu konstruieren, könnte man dem warmen Reservoir unentwegt Energie entnehmen und damit Arbeit verrichten. Die dissipierte Arbeit würde dann dem kalten Reservoir zugeführt und käme über den erwähnten Kreisprozess wieder dem warmen Reservoir zugute. Äquivalent dazu ist die Formulierung von William Thomson, dem späteren Lord Kelvin:
„Es existiert kein Kreisprozess, der eine Wärmemenge aus einem Reservoir entnimmt und vollständig in Arbeit verwandelt.“
Ein idealer, jederzeit umkehrbarer Prozess ohne Reibungsverluste wird auch
reversibel genannt. Oft bleibt die Entropie während eines Prozesses unverändert,
,
bekanntes Beispiel ist die adiabate Kompression und Expansion im Zyklus einer Carnot-Maschine.
Man nennt Zustandsänderungen mit konstanter Entropie auch isentrop, allerdings
sind nicht alle isentropen Zustandsänderungen adiabatisch. Ist ein Prozess
adiabatisch und reversibel, folgt jedoch stets, dass er auch isentrop
ist.
Wird in einem Kreisprozess
bei der Temperatur
die Wärme
aufgenommen und die Wärmemenge
bei
wieder abgegeben und erfolgen Wärmeaufnahme und Abgabe reversibel, so gilt, dass
sich die Entropie dabei nicht ändert:
; oder
.
Daraus lassen sich die maximale verrichtete Arbeit
und der maximale Wirkungsgrad
,
der so genannte Carnot-Wirkungsgrad,
ableiten:
Der carnotsche Wirkungsgrad stellt für alle Wärmekraftmaschinen das Maximum an Arbeitsausbeute dar. Reale Maschinen haben meistens einen erheblich geringeren Wirkungsgrad. Bei ihnen wird ein Teil der theoretisch verfügbaren Arbeit dissipiert, z.B. durch Reibung. Folglich entsteht in einer realen Maschine Entropie und es wird mehr Wärme an das kalte Reservoir abgeführt als notwendig. Sie arbeitet also irreversibel.
Der dritte Hauptsatz (der so genannte „Nernstsche Wärmesatz“) legt die Entropie einer perfekt kristallinen Substanz, bei der beispielsweise keine Spinentartung auftritt, am absoluten Nullpunkt als Null fest:
Eine Folgerung ist beispielsweise, dass die Wärmekapazität eines Systems bei tiefen Temperaturen verschwindet, und vor allem, dass der absolute Temperaturnullpunkt nicht erreichbar ist (das gilt auch bei Spinentartung).
Erfüllt eine Substanz nicht die Bedingung perfekt kristallin (wenn z.B. mehrere Konfigurationen vorliegen oder es sich um ein Glas handelt), kann ihr auch am absoluten Nullpunkt eine Entropie zugeschrieben werden (Nullpunktsentropie).
Partielle Ableitungen der Entropie
Aus dem 2. Hauptsatz folgen Aussagen über die partiellen
Ableitungen der Entropie, z.B. nach der Temperatur
oder dem Volumen
.
Mit dem zweiten Hauptsatz gilt zunächst, dass bei reversiblen Zustandsänderungen
ist. Zusammen mit dem ersten Hauptsatz folgt daraus
weil nach dem ersten Hauptsatz für die Innere
Energie
gilt, dass die Summe der dem betrachteten System zugeführten Arbeit
und der zugeführten Wärme
( einzeln keine Zustandsfunktionen! ) eine Zustandsfunktion ergibt,
eben die „Innere Energie“ des Systems. Dabei wurde vorausgesetzt, dass die
Änderungen von Volumen und Temperatur adiabatisch-langsam erfolgen, sodass keine
irreversiblen Prozesse erzeugt werden.
Also
wobei
eingesetzt wurde.
bzw.
.
Ähnliche Beziehungen ergeben sich, wenn das System außer von der Dichte bzw. vom Volumen noch von weiteren Variablen abhängt, z.B. von elektrischen oder magnetischen Momenten.
Aus dem 3. Hauptsatz folgt, dass sowohl
als auch
für
verschwinden müssen, und zwar hinreichend rasch, was (wie man zeigen kann) nur
erfüllt ist, wenn für tiefe Temperaturen nicht die klassische Physik, sondern
die Quantenphysik gilt.
Statistische Physik
In der u.a. von James Maxwell begründeten statistischen Mechanik wird das Verhalten makroskopischer thermodynamischer Systeme durch das mikroskopische Verhalten seiner Komponenten, also Elementarteilchen und daraus zusammengesetzter Systeme wie Atome und Moleküle, erklärt. Bezüglich der Entropie stellt sich die Frage, wie sie hier gedeutet werden kann, und ob der zweite Hauptsatz aus einer mikroskopischen zeitumkehrinvarianten Theorie hergeleitet werden kann.
Ein Mikrozustand ist klassisch
gegeben durch Angabe aller Orte und Impulse der zum System zählenden Teilchen.
Ein solcher Mikrozustand
ist demnach ein Punkt in einem 6N-dimensionalen Raum, der in diesem
Zusammenhang Phasenraum
genannt wird. Die kanonischen
Gleichungen der klassischen Mechanik beschreiben die zeitliche Evolution des
Systems, die Phasentrajektorie. Alle unter gegebenen makroskopischen
Randbedingungen, wie z.B. Gesamtenergie
,
Volumen
und Teilchenzahl
,
erreichbaren Phasenpunkte bilden ein zusammenhängendes Phasenraumvolumen
.
Um 1880 konnte Ludwig Boltzmann auf mikroskopischer Ebene eine Größe finden, die die Definition der thermodynamischen Entropie erfüllt:
Die Konstante
ist die Boltzmannkonstante. Die Entropie ist also proportional zum Logarithmus
des zu den Werten der thermodynamischen Variablen gehörigen Phasenraumvolumens.
Eine äquivalente Formel lautet
(mit
der Wahrscheinlichkeit für den Mikrozustand bei Kenntnis der zum
thermodynamischen System gehörigen Variablen, und dem Integral über den
Phasenraum). Sie führt – wenn man mit
das natürliche Maß auf dem Phasenraum benutzt und die Wahrscheinlichkeit in
Abwesenheit anderer Information als konstant ansieht, (
mit dem Phasenraumvolumen
,
das zu den Werten der thermodynamischen Variablen gehört) – sofort auf die
„Boltzmann-Formel“ (da die Integration unabhaengig von
ist:
und
).
Ihre Ähnlichkeit mit Shannons
Ausdruck für die Information legt nahe, die Entropie als das Informationsdefizit
über den Mikrozustand zu interpretieren, das mit der Kenntnis der
makroskopischen Variablen verbunden ist. Je größer die Entropie ist, desto
weniger weiß man über den mikroskopischen Zustand, desto weniger Informationen
sind über das System bekannt.
Letzteres wurde von E.T. Jaynes unter dem Stichwort „informationstheoretische Entropie“ zu einem Konzept ausgearbeitet, die Entropie als epistemische (er nannte es „anthropomorph“) Größe zu verstehen. Etwa in folgendem Zitat:
“For example, I have been asked several times whether, in my opinion, a biological system, say a cat, which converts inanimate food into a highly organized structure and behavior, represents a violation of the second law. The answer I always give is that, until we specify the set of parameters which define the thermodynamic state of the cat, no definite question has been asked!”
„Zum Beispiel bin ich mehrmals gefragt worden, ob meiner Meinung nach ein biologisches System, etwa eine Katze, die unbelebte Nahrung in hoch organisierte Struktur und Verhalten verwandelt, eine Verletzung des zweiten Hauptsatzes darstellt. Die Antwort, die ich immer gebe, ist, dass, solange wir den Satz an Parametern, die den thermodynamischen Zustand der Katze festlegen, nicht spezifizieren, keine eindeutige Frage gestellt wurde.“
Es wird deutlich, dass die Entropie – wie überhaupt ein thermodynamisches System – erst durch eine Auswahl an Variablen definiert und von diesen abhängig ist. Einem Mikrozustand kann sie nicht zugeordnet werden. Kritisiert wird daran, dass hier die Entropie den Rang einer subjektiven Größe zu haben scheint, was in einer objektiven Naturbeschreibung nicht angemessen ist.
Beweis des zweiten Hauptsatzes
Vor allem Boltzmann versuchte, den 2. Hauptsatz, (dass die Entropie nur zunehmen kann), statistisch herzuleiten. Die anschauliche Vorstellung ist die, dass etwa bei einem Mischungsvorgang etwas sehr Wahrscheinliches passiert, während der umgekehrte Vorgang einer Entmischung sehr unwahrscheinlich wäre. Dies galt es mathematisch zu präzisieren, mit seinem H-Theorem hatte er hier einen Teilerfolg. Allerdings wird mit dem „Loschmidtschen Umkehreinwand“ verdeutlicht, dass mikroskopisch jeder Vorgang genauso rückwärts laufen könnte und daher ein zeitgerichtetes Gesetz mikroskopisch grundsätzlich nicht hergeleitet werden kann. Auch der Wiederkehrsatz stellt die Möglichkeit eines solchen Gesetzes in Frage.
Im informationstheoretischen Konzept verstanden bedeutet der 2. Hauptsatz, dass die Information über den Mikrozustand bei Beobachtung der makroskopischen Variablen nur abnehmen kann. Hier ist der Beweis viel einfacher möglich:
Nach dem Satz von Liouville bleibt das Phasenraumvolumen der mit einem Anfangswert der thermodynamischen Variablen verbundenen Mikrozustände bei der Zeitentwicklung konstant. Wenn man noch voraussetzt, dass die Beschreibung durch die thermodynamischen Variablen eindeutig ist, das heißt alle Mikrozustände makroskopisch gesehen beim selben Endzustand landen, kann also das Phasenraumvolumen der mit diesem Endwert der thermodynamischen Variablen verbundenen Mikrozustände nicht kleiner sein als das anfängliche Phasenraumvolumen. Es kann aber größer sein, da nicht notwendigerweise alle Mikrozustände „angesteuert“ werden. Die Entropie kann also nur zunehmen.
Man kann das anders formulieren. Man unterscheidet zwischen von Neumann oder
"fine-grained" oder "entanglement" Entropie (also der von Mikrophysik,
d.h. wellenmechanisch korrelierten Systemen) und thermischer Entropie
(also der Entropie in klassischer, makroskopischer Thermodynamik, auch genannt
"coarse-grained" Entropie). Ohne Korrelation ist die entanglement Entropie
()
null (jeweils nur ein Zustand,
der "reine Zustand"). Mit entanglement (Korrelation) stehen mehr Zustände zur
Verfügung, und die entanglement Entropie ist größer als null. In der Makrophysik
betrachtet man Phasenraumbereiche, wie das Kugelvolumen ("coarse-graining") um
einen Punkt, also nicht einzelne Punkte bzw. Mikrozustände. Der mit
Anfangsbedingungen definierte Bereich des Phasenraums eines Systems wird
demzufolge von Kugelvolumen bedeckt, die mehr Phasenraumpunkte umfassen als im
mikroskopischen Anfangszustand. Damit ist die "fine-grained" Entropie immer
kleiner als die "coarse-grained" Entropie. Dies ist die Aussage des 2.
Hauptsatzes. Als Information
bezeichnet man die Differenz zwischen coarse-grained Entropie und fine-grained
Entropie. Details findet man im Buch von Susskind und Lindesay.
Die zeitliche Asymmetrie des zweiten Hauptsatzes betrifft hier also die Kenntnis des Systems, nicht die Ontologie des Systems selbst. Dadurch werden die Schwierigkeiten, aus einer bezüglich Zeitumkehr symmetrischen Theorie ein asymmetrisches Gesetz zu erhalten, vermieden. Allerdings geht in den Beweis auch die Eindeutigkeit der thermodynamischen Beschreibung ein, die auf stochastischen Argumenten beruht. Um die zeitliche Asymmetrie des Weltgeschehens zu verstehen, ist weiterhin ein Bezug zum Anfangszustand des Universums nötig.
Entropie als „Maß der Unordnung“
Eine anschauliche, aber wissenschaftlich nicht exakte Deutung der Entropie
ist es, sie als Maß der Unordnung zu verstehen, siehe z.B. das Chemiebuch
von Holleman-Wiberg.(A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9)
Insbesondere beim Betrachten des Bechers im Beispiel
über Mischentropie sieht das rechte Bild mit der vollständigen Vermischung für
die meisten ordentlicher aus, als das linke mit den Schlieren, weshalb es
dann unverständlich erscheint, dieses als den unordentlicheren Zustand
mit höherer Entropie zu bezeichnen.
Diese Definition lässt sich allerdings anhand des rechts stehenden Bildes
mit den bisherigen Definitionen in Einklang bringen. Das Bild stellt einen
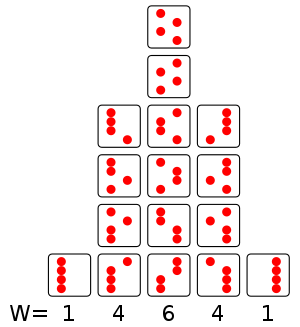
Behälter dar, in dem sich vier Atome befinden, die entweder auf der rechten oder
auf der linken Seite des Behälters sein können. Wenn man annimmt, dass alle 16
Zustände gleich wahrscheinlich sind, sind die Wahrscheinlichkeiten,
für die einzelnen Spalten gerade mit
gegeben, wobei das
aus dem Bild gerade die Anzahl der Zustände in den jeweiligen Spalten
bezeichnet.
Nehmen wir nun an, dass wir makroskopisch unterscheiden könnten, wie viele
Atome sich auf der linken Seite befinden. Die erste Spalte hat
N = 4 Atome links, die zweite hat N = 3 Atome
links usw. Die Wahrscheinlichkeit, dass sich alle vier Atome auf der linken
Seite befinden, wäre als Beispiel daher gerade ,
während die mittlere Spalte eine höhere Wahrscheinlichkeit von
besitzt. Mit der Formel
hat der makroskopische Zustand mit N = 2 also die höchste
Entropie.
In diesem Bild erkennt man nun aber auch deutlich, dass die erste und letzte Spalte ordentlicher sind als die dazwischenliegenden Fälle mit höherer Entropie. Es können nun folgende Feststellungen gemacht werden: wenn alle 16 Zustände gleich wahrscheinlich sind und man beginnt mit dem Zustand N = 4, ist es sehr wahrscheinlich, bei der nächsten Betrachtung einen der Zustände höherer Entropie vorzufinden. Allerdings kann das System auch von der mittleren Spalte in die erste oder letzte übergehen; es ist nur unwahrscheinlicher, den Zustand N = 4 mit niedriger Entropie vorzufinden als den Zustand mit N = 2. In diesem rein statistischen Sinne kann das System also auch spontan in einen Zustand niedrigerer Entropie wechseln, es ist nur unwahrscheinlich, dass er das tut.
Dies ist immer noch der Fall, wenn man
Atome in einem Behälter betrachtet. Die Wahrscheinlichkeit, dass diese spontan
in den Zustand niedrigerer Entropie wechseln, bei dem sich alle Atome links
befinden ist nicht auszuschließen, aber sehr unwahrscheinlich.
Entropie als mengenartige Größe
Für die Entropie als extensive Größe kann eine lokale Bilanzgleichung (Kontinuitätsgleichung) formuliert werden:
Hier ist
die Dichte der Entropie,
die Stromdichte und
die Erzeugungsrate pro Volumen. In manchen Lehrwerken zur Physik, insbesondere
denen des Karlsruher
Physikkurses, wird eine Vorstellung der Entropie als eine extensive und
„mengenartige
Größe“ nahegelegt. Im Fall der Entropie ist das, was sie misst, nach Wilhelm Ostwald und Hugh
Longbourne Callendar mit dem Carnot’schen Caloricum zu identifizieren.
Da das Caloricum weitgehend mit dem umgangssprachlichen Wärmebegriff
übereinstimmt, kann die Entropie demnach auch als Maß für die
(umgangssprachliche) Wärme verstanden werden.
Man beachte dabei, dass in der Kontinuitätsgleichung auf der rechten Seite eine
Erzeugungsrate
steht, weshalb aus ihr kein Erhaltungssatz
abgeleitet werden kann.
Von zwei ansonsten gleichen Körpern enthält derjenige mehr Entropie, dessen Temperatur höher ist. Fasst man zwei Körper zu einem einzigen System zusammen, ist die Gesamtentropie die Summe der Entropien beider Körper.
Stehen zwei Körper unterschiedlicher Temperatur miteinander in wärmeleitendem Kontakt, verursacht die Temperaturdifferenz einen Entropiestrom. Aus dem wärmeren Körper fließt Entropie ab, wodurch sich dessen Temperatur absenkt. Der kältere Körper nimmt diese Entropie (und die zusätzlich in diesem Prozess neu erzeugte Entropie) auf, wodurch seine Temperatur steigt. Der Prozess kommt zum Erliegen, wenn die Temperaturen beider Körper gleich geworden sind.
Als mengenartige Größe ist die Entropie zum Beispiel mit der elektrischen Ladung vergleichbar (für die allerdings ein strikter Erhaltungssatz gilt): Ein geladener Kondensator enthält elektrische Ladung, und damit auch elektrische Energie. Beim Entladevorgang fließt über den Stromkreis nicht nur elektrische Ladung von der einen Kondensatorplatte auf die andere, sondern es fließt auch Energie vom Kondensator zu einem Verbraucher, wo sie in andere Energieformen umgewandelt werden kann. Entsprechend wird bei der Wärmeübertragung von einem heißen auf einen kalten Körper außer der thermischen Energie noch eine andere mengenartige Größe übertragen: die Entropie. Genauso wie der Potentialunterschied zwischen den Kondensatorplatten – sprich: die elektrische Spannung – den elektrischen Strom antreibt, sorgt der Temperaturunterschied zwischen den beiden Reservoirs für einen Entropiestrom. Befindet sich zwischen den beiden Körpern eine Wärmekraftmaschine, kann ein Teil der Wärme in eine andere Energieform umgewandelt werden. Die Wärmeübertragung lässt sich also rein formal analog zu einem elektrischen Stromkreis beschreiben, wobei allerdings die während des Vorgangs neu erzeugte Entropie zusätzlich zu berücksichtigen ist.
Eine Energieübertragung – also die Arbeit
oder die Wärme
– lässt sich als das Produkt aus der Änderung einer mengenartigen extensiven
Größe mit einer konjugierten intensiven Größe schreiben. Beispiele für solche
Paare sind die elektrische Ladung
und das elektrische
Potential
oder das Volumen und der (negative) Druck eines Gases. Durch Zufuhr der
extensiven Größe steigt (im Allgemeinen) die intensive Größe. Fügt man
beispielsweise eine kleine Ladungsmenge
einer Kondensatorplatte zu, die sich auf dem Potential
befindet, verrichtet man an der Kondensatorplatte die Arbeit
und erhöht damit das Potential der Platte. Entsprechendes gilt auch für andere
Größenpaare. Für thermische Vorgänge entspricht nun die Temperatur dem Potential
und die Entropie der Ladung: Wenn man einem Körper die Entropiemenge
hinzufügt, wird die Wärme
übertragen und es steigt (außer bei Phasenumwandlung) die Temperatur
.
Die Entropie ist zwar keine Erhaltungsgröße
wie die elektrische Ladung, denn Entropie kann erzeugt werden. Nach dem zweiten
Hauptsatz der Thermodynamik kann sie aber nicht vernichtet werden. Es gilt
also .
Solange in einem abgeschlossenen System die Entropie gleich bleibt
,
sind alle Vorgänge, die sich in dem System abspielen, umkehrbar (=
reversibel). Sobald jedoch Entropie erzeugt wird
,
was z.B. durch Reibung, durch Erwärmung eines ohmschen Widerstandes oder
durch Mischungsvorgänge geschehen kann, gibt es kein Zurück mehr, ohne dass
durch äußeres Zutun Entropie abfließen kann. Man spricht dann von
irreversiblen Vorgängen.
Eine weitere Besonderheit der Entropie ist, dass man einem Körper nicht beliebig viel Entropie entziehen kann. Während man der Platte eines Kondensators Ladung zuführen und wegnehmen kann, wodurch das Potential positiv oder negativ wird, gibt es für die Entropieentnahme eine natürliche Grenze, nämlich den absoluten Nullpunkt der Temperatur. Insbesondere kann die absolute Temperatur nie negativ werden.
Anwendungsbeispiele
Mischung von warmem und kaltem Wasser
Die Zunahme der Entropie wird an einem System, das mit der Umgebung weder Masse noch Energie austauscht (abgeschlossenes System), durch die Vermischung von zwei Wassermengen unterschiedlicher Temperatur gezeigt. Da es sich um einen isobaren Vorgang handelt, wird für die Energiebilanz die Zustandsgröße Enthalpie verwendet.
Zustandsgrößen für Wasser nach den Gleichungen aus: Properties of Water and Steam Industrie-Standard IAPWS-IF97
System10: Masse m10 = 1 kg, Druck = 1 bar, Temperatur = 10 °C, Enthalpie h10 = 42,12 kJ/kg, Entropie s10 = 151,1 J/kg K; System30: Masse m30 = 1 kg, Druck = 1 bar, Temperatur = 30 °C, Enthalpie h30 = 125,83 kJ/kg, Entropie s30 = 436,8 J/kg K
Irreversible Mischung
Der thermodynamische Zustand der irreversiblen Mischung (adiabat, keine Abgabe von Arbeit) ergibt sich aus dem Energieerhaltungssatz:
HM = H10 + H30, hM = (m10*h10 + m30*h30)/(m10 + m30), hM = 83,97 kJ/kg
Mit den Zustandsgrößen Enthalpie und Druck ergeben sich weitere Zustandsgrößen des Mischungszustandes:
Temperatur tM = 19,99 °C (293,14 K), Entropie sM = 296,3 J/kg K
Reversible Mischung
Bei einer reversiblen Vermischung (dSirr = 0) nimmt die Entropie des Gesamtsystems nicht zu, sie ergibt sich aus der Summe der Entropien der Teilsysteme:
SM = S10 + S30 + dSirr, sM = 293,9 J/kg K
Mit den Zustandsgrößen Entropie und Druck ergeben sich weitere Zustandsgrößen des Mischungszustandes:
Temperatur tM = 19,82 °C (292,97 K), Enthalpie hM = 83,26 kJ/kg
Das Gesamtsystem ist in diesem Fall nicht mehr abgeschlossen, sondern tauscht mit der Umgebung Arbeit aus.
Differenzen zwischen irreversibler und reversibler Mischung: Entropie: 2,4 J/kg K, Enthalpie: 0,71 kJ/kg, Temperatur: 0,17 K
Nach der irreversiblen Mischung ist die Entropie des Gesamtsystems um 2,4 J/kg K größer als beim reversiblen Vorgang. Die reversible Mischung könnte durch den Einsatz einer Carnot-Maschine erreicht werden. Dabei würde dem Teilsystem mit der höheren Temperatur eine unendlich kleine Menge Energie entnommen. In Form von Wärme wird diese Energie an der Systemgrenze bei einer unendlich kleinen Temperaturdifferenz an die Carnot-Maschine übertragen. Auf entsprechende Weise wird die Energie dem Teilsystem mit der tieferen Temperatur zugeführt. Die Temperaturen der beiden Teilsysteme würden sich dadurch immer weiter angleichen und der Carnot-Faktor der Maschine von anfänglich 0,066 gegen Null streben. Die Carnot-Maschine würde dabei dem Gesamtsystem die sonst entwertete Enthalpiedifferenz von 0,71 kJ/kg als mechanische Arbeit entnehmen. Im irreversiblen Fall entspricht diese Energie der innerhalb des Systems dissipierten Arbeit entsprechend Gleichung (3). Durch die dissipierte Arbeit wird die produzierte Entropie vom absoluten Nullpunkt auf die Temperatur von 19,99 °C angehoben.
Mischungsentropie

Das Bild rechts zeigt die Mischung einer braunen Farbe in Wasser. Zu Beginn ist die Farbe ungleichmäßig verteilt. Nach längerem Warten nimmt das Wasser eine gleichmäßige Färbung an.
Die Entropie ist ein Maß der Unwissenheit, d.h. der Unkenntnis darüber, in welchem mikroskopischen Zustand sich das betrachtete System befindet. Als Maß der Unordnung muss man auf die Begrifflichkeit achten. So ist im Bildbeispiel die Flüssigkeit im rechten Glas zwar „ordentlicher“ verrührt, aber durch die große Durchmischung von Wasser- und Farbteilchen herrscht dort eine größere Unordnung. Es gibt dort mehr mikroskopisch mögliche Zustände, in denen das Glas sein könnte. Mithin ist dort die Entropie höher als im linken Glas. Von der Farbe wissen wir, dass sie im rechten Glas überall im Wasser verteilt ist. Das linke Bild sagt uns mehr. Wir können Bereiche ausmachen, in denen Farbe in hoher Konzentration anzutreffen ist, oder Bereiche, die frei sind von Farbe.
Josiah Willard Gibbs wies auf den Widerspruch hin, dass der Entropiezuwachs auch auftreten sollte, wenn statt der Tinte Wasser ins Wasserglas gegossen wird (Gibbssches Paradoxon).
Die Zahl der Anordnungen der Farbmoleküle am Anfang ist deutlich geringer als die, wenn sich die Farbe im gesamten Volumen verteilen kann. Denn die Farbmoleküle sind nur auf wenige Bereiche konzentriert. Im rechten Bild können sie sich im gesamten Glas aufhalten. Die Entropie ist hier größer, weshalb das System im Laufe der Zeit dieser Gleichverteilung zustrebt.
Entropiezunahme bei irreversibler und reversibler isothermer Expansion
Es gibt zwei Experimente, in denen, vom gleichen Anfangszustand ausgehend, über eine isotherme Expansion der gleiche Endzustand erreicht wird und bei Vergrößerung des Volumens dieselbe Entropieänderung eintritt. Eines ist der Gay-Lussac-Versuch, er dient als Modell für die Vorstellung des Entropiebegriffs nach Boltzmann. Das zweite Experiment, an dem man die Formulierung der Entropie nach Clausius nachvollziehen kann, ist die isotherme Ausdehnung im ersten Schritt des Carnot-Zyklus.
Irreversible Expansion, thermodynamisch
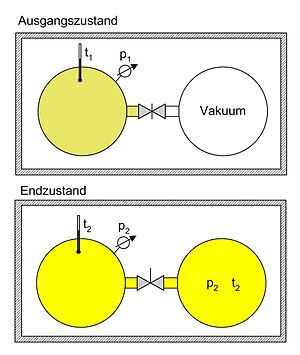
Die nebenstehende Abbildung zeigt das Überströmexperiment von Gay-Lussac.
Wenn man von einem ideal abgeschlossenen System ausgeht, besagt der erste
Hauptsatz der Thermodynamik, dass sich die Gesamtenergie des Systems nicht
ändert ().
Für ein ideales Gas gilt daher, dass beim Überströmen in ein größeres Volumen
insgesamt keine Temperaturänderung stattfindet.
Da die Entropie eine Zustandsgröße ist, ist sie wegunabhängig. Anstatt den
Hahn zu öffnen, kann man sich auch vorstellen, dass das Gas langsam expandiert,
indem es eine Trennwand nach rechts schiebt. Für eine infinitesimale
Verschiebung vergrößert sich das Volumen um ,
die Entropie steigt um
.
Aus dem ersten Hauptsatz
folgt wegen
,
dass sämtliche vom Gas geleistete Expansionsarbeit ihm wieder in Form von Wärme
zugutekommen muss. Es gilt also
.
Daraus ergibt sich
und somit
Aus der Zustandsgleichung
für ideale Gase (
ist die Anzahl der Gasatome):
folgt:
.
Hieraus ergibt sich durch Integration:
.
Für ein Mol eines Gases ergibt sich bei Verdopplung des Volumens
durch Einsetzen von Zahlenwerten für die Boltzmannkonstante
und Avogadro-Zahl
.
Irreversible Expansion, statistisch
Die Überlegung geht vom Überströmversuch nach Gay-Lussac aus. Ein Hahn wird
geöffnet und ein ideales Gas breitet sich spontan über das doppelte Volumen aus.
Nach Boltzmann erhält man über die statistischen Gewichte (=Anzahl der
Mikrozustände) vor und nach der Expansion die jeweils entsprechenden
Entropiewerte: Sind
Moleküle auf zwei Raumhälften so verteilt, dass sich in der einen Hälfte
und in der anderen
Moleküle befinden, dann ist das statistische Gewicht dieses Makrozustands
und die Entropie dieses Zustands .
Befindet sich ein ganzes Mol (
)
in einer Hälfte (und in der anderen nichts), dann ist
und die Entropie
.
Bei gleichmäßiger Aufteilung wird
.
Die Fakultät kann man mit der Stirling-Formel
annähern, wobei man sich auf
beschränken kann. Der Logarithmus von
ist
.
Damit wird
und
.
Man erhält für die Entropie nach der Expansion
.
.
Da die Teilchen keine Anziehungskräfte besitzen und die Wände des Gefäßes starr sind, wird keine Arbeit geleistet, auch nicht gegen einen äußeren Luftdruck. Die Moleküle prallen zwar gegen die Wand und werden reflektiert, verlieren dabei jedoch keine Energie. Das System ist während des Überströmens nicht im Gleichgewicht.
Reversible isotherme Expansion
Das zweite Experiment entspricht der isothermen Ausdehnung im ersten Schritt
des Carnot-Zyklus. Wärme wird von außen auf die Substanz übertragen. Damit wird
Arbeit geleistet, indem die ihr entsprechende Energie im Lauf der Expansion
abgegeben wird an eine angeschlossene Mechanik, die sie als potenzielle Energie
extern speichert. Davon verbleibt nichts im Medium und das System ist stets im
Gleichgewicht. Der Vorgang ist umkehrbar. Clausius hat nun die Änderung der
Entropie unter Einbeziehung dieser zugeführten Wärme formuliert als .
Mit
erhält man im reversiblen Fall für ein Mol ebenfalls
.
Numerische Äquivalenz der Ergebnisse
Zur Boltzmann-Konstanten :
In der Überlegung nach Boltzmann anhand des Überströmversuchs kommt erst einmal
weder eine Wärme noch eine Temperatur vor, also keine dimensionsbehaftete Größe,
sondern nur der Logarithmus dimensionsloser statistischer Gewichte,
.
Da aber die Entropieänderung dieselbe ist (gleicher Anfangs- und Endzustand;
Zustandsfunktion) wie im reversiblen Fall, führte Planck
die Konstante
ein. Mit ihr erhält man für die Änderung der Entropie bei der irreversiblen
isothermen Expansion dasselbe numerische Ergebnis mit der gleichen Einheit J/K
wie für die reversible aus dem Experiment, bei dem Wärme zugeführt wird. Dies
ist im realen Experiment allerdings erst dann der Fall, wenn das System das
Gleichgewicht, also das maximale statistische
Gewicht nach der Boltzmann-Verteilung
erreicht hat.
Biomembranen
Gibt man Lipide,
bei Lebewesen beispielsweise als
Bausteine der Biomembranen
vorkommend, in Wasser, so bilden sich spontan geschlossene Membranstrukturen,
sogenannte Vesikel.
Da hier Temperatur und Druck gegeben sind (Wärmebad
und Druckensemble)
ist das thermodynamische
Potential, das ein Minimum anstrebt die freie
Enthalpie .
Die Enthalpie
lässt sich experimentell nachweisen, ist also messbar und ist positiv. Da der
Prozess spontan abläuft, muss aber
negativ sein; d.h., die Entropie muss steigen. Dies ist auf den ersten
Blick verwirrend, da die Entropie meistens die Ursache dafür ist, dass sich
Stoffe vermischen (Mischungsentropie). Die Entropiezunahme liegt in einer
besonderen Eigenschaft des Wassers begründet. Es bildet zwischen den einzelnen
Wassermolekülen Wasserstoffbrückenbindungen
aus, die ständig fluktuieren und somit einen hohen Beitrag zur Entropie des
Wassers leisten. Um die langen Fettsäureketten der Lipide entsteht bei Lösung in
Wasser ein größerer Bereich, in dem keine Wasserstoffbrückenbindungen mehr
gebildet werden können. In den Bereichen um die Fettsäureketten herum fehlt der
Entropiebeitrag der Wasserstoffbrücken, so dass die Entropie insgesamt abnimmt.
Diese Abnahme ist erheblich größer als die durch das bloße Vermischen des
Wassers und des Lipids zu erwartende Zunahme. Wenn sich die Fettsäureketten
zusammenlagern, können mehr Wasserstoffbrücken gebildet werden, und die Entropie
steigt. Man könnte dies auch so formulieren, dass die Fähigkeit des Wassers,
fluktuierende Wasserstoffbrücken zu bilden, die Lipide aus der Lösung treibt.
Letztlich ist diese Eigenschaft auch mit die Ursache für die schlechte
Löslichkeit vieler unpolarer Stoffe, die die Bildung von
Wasserstoffbrückenbindungen stören.
Berechnung und Verwendung tabellierter Entropiewerte
Die molare Entropie Smol bei einer bestimmten Temperatur T2 und bei konstantem Druck p erhält man mit Hilfe der molaren Wärmekapazität cp(T) durch Integration vom absoluten Nullpunkt bis zur aktuellen Temperatur:
Dazu kommen noch Entropieanteile bei Phasenübergängen. Nach Planck wird die Entropie ideal kristallisierter, reiner Festkörper am absoluten Nullpunkt gleich null gesetzt (Gemische oder frustrierte Kristalle behalten dagegen eine Restentropie). Unter Standardbedingungen spricht man von der Standardentropie S0. Auch nach der statistischen Betrachtungsweise hängen Entropiewert und Wärmekapazität miteinander zusammen: Eine hohe Wärmekapazität bedeutet, dass ein Molekül viel Energie speichern kann, und das kann z.B. auf einer großen Zahl niedrig liegender und daher leicht erreichbarer Energieniveaus beruhen. Entsprechend viele unterschiedliche Verteilungsmöglichkeiten auf diese Niveaus gibt es dann auch für die Moleküle und das führt auch auf einen hohen Entropiewert für den wahrscheinlichsten Zustand.
In elektrochemischen Reaktionen ergibt sich die Reaktionsentropie ∆S aus der gemessene Änderung von dE (elektromotorische Kraft) mit der Temperatur:
(z = Ladungszahl, F = Faraday-Konstante)
Die Entropieänderung bei idealen Mischungen erhält man mit Hilfe der Molenbrüche xi der beteiligten Substanzen:
wobei sich in realen Mischungen noch eine Zusatzentropie durch die Veränderung der zwischenmolekularen Kräfte beim Mischen ergibt.
Entstehen bei einer chemischen Reaktion neue Moleküle, dann tritt die höchste Entropie in einem ganz bestimmten Gleichgewichtszustand auf, bei dem sich die Moleküle sowohl auf die Edukt- wie auch auf die Produktniveaus verteilen können. Über die folgende Beziehung, in der die Differenzen der Standard-Entropiewerte ∆S0 der beteiligten Substanzen eine wesentliche Rolle spielen, kann die Gleichgewichtskonstante K berechnet werden:
(das ∆ bedeutet in diesem Fall die Änderung der Größe bei vollständigem Reaktionsablauf). Woran man bei einem spontanen Vorgang (z.B. chemischen Reaktionen, Lösungs- und Mischungsvorgängen, Einstellung von Phasengleichgewichten und deren Temperaturabhängigkeit, Osmose u.a.) die Intensität dieses Vorgangs abschätzen kann, das ist die Zunahme der gesamten Entropie zwischen Anfangs- und Gleichgewichtszustand, die der Reaktanten und die der Umgebung zusammengenommen (→ chemisches Gleichgewicht). Die spontane Zunahme der Entropie wiederum ist eine Folge der ständigen Bewegung der Moleküle.
Kurz: Die Standard-Entropie von Stoffen kann aus dem Verlauf der Wärmekapazität mit der Temperatur berechnet werden. Die Kenntnis tabellierter Entropiewerte ermöglicht (zusammen mit den Reaktionsenthalpien) die Voraussage des chemischen Gleichgewichts.
Quantenmechanik
In der Quantenstatistik
ist ein Mikrozustand ein reiner
Zustand, der durch einen Vektor
im Hilbertraum
des Vielteilchensystems
gegeben ist. Wie in der klassischen statistischen Mechanik ist dies ein Raum mit
außerordentlich vielen Dimensionen, selbst wenn dem einzelnen Teilchen nur
wenige verschiedene Energieeigenzustände
zur Verfügung stehen. Zum Beispiel gibt es bei der magnetischen
Kernresonanz für jeden Protonenspin nur zwei Energieeigenzustände, damit
aber einen Hilbertraum mit doppelt so vielen Dimensionen, wie Protonen in der
Probe sind (etwa
in einem kleinen Wassertröpfchen). Der zugehörige Makrozustand ist ein gemischter Zustand,
der durch einen statistischen Operator oder auch Dichteoperator
beschrieben wird.
Dieser enthält alle Informationen über das System, die durch eine ideale
Messung zugänglich sind (das ist viel weniger als bei dem reinen
Zustand ,
dem Mikrozustand). Der Makrozustand ist klassisch gegeben durch
ein Ensemble von denjenigen Mikrozuständen, die mit
bestimmte „typische makroskopische Größen“ gemein haben, wie z.B. Energie,
Volumen und Teilchenzahl. Die Verteilung der Mikrozustände im Phasenraum ist
klassisch durch eine Verteilungsfunktion gegeben. An deren Stelle tritt in der
quantenmechanischen Beschreibung der Dichteoperator:
.
Falls die Zustände
alle orthogonal sind, ist
die Wahrscheinlichkeit, dass sich das betrachtete System im „reinen“
quantenmechanischen Zustand
befindet.
Der Erwartungswert einer Observablen auf dem durch den Dichteoperator beschriebenen Zustandsgemisch ist gegeben durch eine Spurbildung:
.
Die Spur
eines Operators ist folgendermaßen definiert:
für eine beliebige (vollständige) Basis
.
Von-Neumann-Entropie
Die Von-Neumann Entropie (nach John von Neumann) ist definiert als Erwartungswert des Dichteoperators:
.
Multipliziert man diese dimensionslose Von-Neumann-Entropie mit der Boltzmann-Konstanten
,
so erhält man eine Entropie mit der gewöhnlichen Einheit.
Die Entropie ist über die Wahrscheinlichkeiten der einzelnen reinen
quantenmechanischen Zustände
im Makrozustand gegeben durch
,
wobei
die Wahrscheinlichkeit ist, im i-ten Mikrozustand zu sein. Die
Wahrscheinlichkeiten
können Werte zwischen
und
annehmen. (Die Singularität des Logarithmus im Falle
ist unerheblich, weil
.)
Somit ist
und die Entropie
positiv
semidefinit. Liegt das Gemisch in einem reinen Zustand vor, hat eine dieser
Wahrscheinlichkeiten den Wert
,
während alle anderen den Wert Null annehmen. In diesem Fall ist die Entropie
Null, hat also den Minimalwert. Positive Werte der Entropie erhält man, wenn
mehr als ein Mikrozustand eine von Null verschiedene Wahrscheinlichkeit haben.
Als Beispiel nehmen wir ein Spinsystem mit vier Elektronen. Spin und
magnetisches Moment sind antiparallel. Das heißt, das magnetische Moment
eines nach unten zeigenden Spins besitzt im äußeren Magnetfeld
die Energie
.
Die Energie
des Systems soll insgesamt
sein. Dies führt zu den vier Mikrozuständen:
Daraus folgt, dass die Spinentartung
ist mit
und wie oben auch hier
gilt.
Die obige allgemeine Formel, (*), ist bis auf einen konstanten Faktor identisch mit der Formel für die Shannon'sche Informationsentropie. Das bedeutet, die physikalische Entropie ist auch ein Maß für die Information, die einem durch Kenntnis des Makrozustands zum Mikrozustand fehlt.
Eigenschaften der statistischen Entropie eines quantenmechanischen Zustandes
Seien
und
Dichteoperatoren auf dem Hilbertraum
.
- Invarianz unter unitären
Transformationen von
(mit
)
- Minimum
- Minimum wird bei reinen Zuständen
angenommen
- Maximum
- Maximum wird angenommen, wenn alle möglichen Zustandsvektoren mit gleicher
Wahrscheinlichkeit
auftreten
mit
- Sei
Dichteoperator auf
und
bzw.
reduzierte Dichteoperatoren auf
bzw.
Bekenstein-Hawking-Entropie von Schwarzen Löchern
Jacob Bekenstein
stellte in seiner Doktorarbeit Ähnlichkeiten zwischen der Physik Schwarzer Löcher und der
Thermodynamik heraus.
Unter anderem verglich er den Zweiten Hauptsatz der Thermodynamik
damit, dass die Oberfläche von Schwarzen Löchern mit einfallender Materie
anscheinend immer anwächst und keine Materie entweichen kann. Es ergab sich als
Formel für die Entropie
,
Hier ist
die Oberfläche des Ereignishorizonts,
die Gravitationskonstante,
die Lichtgeschwindigkeit
und
die Boltzmannkonstante.
Stephen Hawking kritisierte daran, dass damit das Schwarze Loch auch eine Temperatur
besitzen müsse. Ein Körper mit einer nicht verschwindenden Temperatur emittiert
jedoch eine Schwarzkörperstrahlung,
die der Annahme widerspricht, dass aus dem Schwarzen Loch nichts mehr entweicht.
Hawking löste dieses Paradoxon durch die Entdeckung der nach ihm benannten Hawking-Strahlung
auf: In der quantenmechanischen Beschreibung des Vakuums sind ständig Vakuumfluktuationen
aus Teilchen-Antiteilchen-Paaren vorhanden. Wenn bei einer Paarbildung knapp
außerhalb des Ereignishorizonts eines der beiden Partnerteilchen vom Schwarzen
Loch „eingefangen“ wird, das andere aber entkommt, entspricht dies physikalisch
einer thermischen Strahlung des Schwarzen Lochs.
Zur Realität solcher thermischer Strahlung ist zu sagen, dass Beobachter in
unterschiedlichen Bezugssystemen unterschiedliche Beobachtungen machen, also
Temperatur
oder Eigentemperatur. Erst die Entdeckung von Hawking, dass ein Beobachter, der
von einem schwarzen Loch mit Ereignishorizont bei
weit entfernt ist, die Schwarzschild-Temperatur
beobachtet, und Untersuchung einer freien Quantenfeldtheorie in Rindler-Raum-Koordinaten, führte zu der Erkenntnis der Hawking-Strahlung als Evaporation des schwarzen Lochs von Teilchen mit niedrigem Drehimpuls, während andere mit höheren Drehimpulsen von den Wänden des Lochs reflektiert werden.
Das Schwarze Loch kann sich auflösen, wenn die Energie der abgestrahlten Hawking-Strahlung (durch die die Masse des Schwarzen Lochs abnimmt) für einen ausreichend langen Zeitraum den Energieinhalt der einfallenden Materie übersteigt.
Literatur
- G. Adam, O. Hittmair: Wärmetheorie. 4. Auflage. Vieweg, Braunschweig 1992, ISBN 3-528-33311-1.
- Richard Becker: Theorie der Wärme. 3., erg. Auflage. Springer, 1985, ISBN 3-540-15383-7.
- E. P. Hassel, T. V. Vasiltsova, T. Strenziok: Einführung in die Technische Thermodynamik. FVTR GmbH, Rostock 2010, ISBN 978-3-941554-02-3.
- H. Dieter Zeh: Entropie. Fischer, Stuttgart 2005, ISBN 3-596-16127-4.
Anmerkungen
- ↑
Beim 1.
Hauptsatz der Thermodynamik tritt im Gegensatz zum 2.
Hauptsatz ein solcher „integrierender Faktor“ nicht auf. Der 1. Hauptsatz
besagt, dass die Summe (!) der zugeführten Arbeit,
und der zugeführten Wärme
immer das vollständige Differential
einer Zustandsfunktion
ergibt, der sogenannten Inneren Energie, obwohl die zwei einzelnen Differentiale nicht vollständig sind. Bei der Funktion
wird im Gegensatz zu
auch nicht unterschieden, ob die Wärmezufuhr reversibel oder irreversibel erfolgt.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 26.07. 2025
