
Flüssigsauerstoff
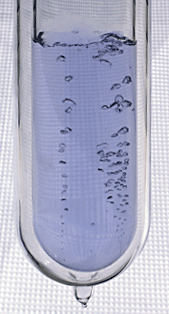
Flüssigsauerstoff (auch LOX in der Industrie (von englisch Liquid Oxygen)) ist die flüssige Form des Elements Sauerstoff.
Herstellung und Verwendung
Flüssigsauerstoff ist ein Industrieprodukt und kommerziell erhältlich. Er wird in großem Maße für industrielle und medizinische Zwecke eingesetzt. Flüssigsauerstoff wird aus dem in der Luft enthaltenen Sauerstoff nach dem Linde-Verfahren durch fraktionierte Destillation hergestellt.
Aufgrund der kryogenen Natur von Flüssigsauerstoff kann er bei Kontakt mit Materialien diese stark brüchig machen. Flüssigsauerstoff ist auch ein starkes Oxidationsmittel (noch stärker als gasförmiger Sauerstoff), da sich angeregter Singulett-Sauerstoff in der flüssigen Phase vermehrt anreichert. Reduktionsmittel, insbesondere organische Materialien, brennen daher schnell und stark in flüssigem Sauerstoff oder können beim Kontakt mit Flüssigsauerstoff sogar unerwartet detonieren, etwa Öle, Fette und Asphalt, aber auch anorganische Stoffe wie Phosphor oder Magnesium. Anlagen zur Verwendung oder Lagerung von Flüssigsauerstoff müssen daher vollkommen fett- und ölfrei sein.
Flüssigsauerstoff als Oxidationsmittel ist ein üblicher Treibstoff für Raketen mit einem Flüssigkeitsraketentriebwerk die heute vor allem in der Raumfahrtindustrie eingesetzt werden, normalerweise in Verbindung mit Kerosin oder Flüssigwasserstoff als zu oxidierende Treibstoffe. Er ist in dieser Rolle nützlich, da er ein günstiges und relativ ungiftiges Oxidationsmittel ist, und einen starken spezifischen Impuls erzeugt. Er wurde in den allerersten Raketen wie der A4/V2 benutzt (unter dem Namen A-Stoff) und in Triebwerken von Redstone, R-7 Semyorka und Atlas.
Flüssigsauerstoff wurde bei früher gebauten Interkontinentalraketen sowie bei modernen Raketen benutzt, etwa den Haupttriebwerken des Space Shuttles. Modernere Interkontinentalraketen verzichten auf den Einsatz von Flüssigsauerstoff, da die kryogenen Eigenschaften und die Notwendigkeit, den verdunstenden Flüssigsauerstoff regelmäßig nachfüllen zu müssen, die Einsatzbereitschaft der Raketen negativ beeinflussen. Flüssigsauerstoff wurde früher zur Herstellung von Sprengstoffen („Oxyliquit“) benutzt.
Flüssigstickstoff hat einen niedrigeren Siedepunkt (−196 °C, 77 K) als Sauerstoff (−183 °C, 90 K). Auf Leitungen, die Flüssigstickstoff enthalten, kann Sauerstoff aus der Luft kondensieren. Der angereicherte Sauerstoff kann gegebenenfalls mit organischem Material spontan reagieren. Flüssigstickstoff oder Flüssigluft reichern sich bei offener Lagerung mit Sauerstoff an, da dieser sich aus der Atmosphäre im Flüssigstickstoff löst.
Physikalische Eigenschaften
Flüssiger Sauerstoff ist tiefkalt, hat eine schwach blaue Farbe und ist stark paramagnetisch. Er hat eine Dichte von 1,141 g/cm³ (1,141 kg/l) (bei Siedetemperatur und Normaldruck 101,325 kPa), und ist mäßig kryogen (Gefrierpunkt: 50,5 K (−222,65 °C), Siedepunkt: 90,188 K (−182,96 °C) bei 101,325 kPa (760 mm Hg)). Flüssigsauerstoff hat eine Expansionsrate von 860:1 bei 20 °C und wird deshalb in manchen kommerziellen und militärischen Luftfahrzeugen als Quelle für Sauerstoff zum Atmen benutzt.
Das Tetrasauerstoff-Molekül (O4) wurde zuerst von Gilbert N. Lewis 1924 vorhergesagt, der das Molekül als eine Erklärung dafür vorschlug, dass Flüssigsauerstoff nicht dem Curieschen Gesetz folgt. Computersimulationen weisen darauf hin, dass, obwohl keine stabilen O4-Moleküle in Flüssigsauerstoff vorliegen, O2-Moleküle sich zu Paaren mit antiparallen Spins zusammenlagern und so vorübergehende O4-Einheiten bilden.
Geschichte
Louis Paul Cailletet und Raoul Pictet gelang die Beobachtung von Tröpfchen flüssiger Luft und damit der Nachweis, dass sich Luft verflüssigen ließ. Die erhaltenen Tröpfchen verdampften allerdings spontan. Erst Karol Olszewski und Zygmunt Florenty Wróblewski gelang 1883 an der Jagiellonen-Universität in Polen als Ersten die stabile Verflüssigung von Stickstoff, Kohlenstoffdioxid und Sauerstoff.
Siehe auch


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 18.03. 2023