
Natriumhydroxid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | Schweiz: 2 mg/m3 (gemessen als einatembarer Staub) | ||||||

Natriumhydroxid (auch Ätznatron, kaustische(s) Soda), chemische Formel NaOH, ist ein weißer hygroskopischer Feststoff. Mit einer Weltproduktion von 60 Millionen Tonnen im Jahr 2010 gehört die Verbindung zu den bedeutendsten chemischen Grundstoffen und wird überwiegend in Form von Natronlauge gehandelt.
| Kristallstruktur | ||
|---|---|---|
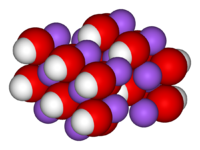 | ||
| _ Na+ __ OH− | ||
| Allgemeines | ||
| Name | Natriumhydroxid | |
| Andere Namen | ||
| Verhältnisformel | NaOH | |
| Kurzbeschreibung | weißer, geruchsloser, hygroskopischer Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 215-185-5 | |
| ECHA-InfoCard | 100.013.805 | |
| PubChem | 14798 | |
| ChemSpider | 14114 | |
| DrugBank | DB11151 | |
| Eigenschaften | ||
| Molare Masse | 39,997 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte |
| |
| Schmelzpunkt | 323 °C | |
| Siedepunkt | 1390 °C | |
| Löslichkeit |
| |
Herstellung
Im Labor kann Natriumhydroxid durch Umsetzung von Natriumcarbonat mit Calciumhydroxid zu Natriumhydroxid und Calciumcarbonat hergestellt werden:
Das wenig lösliche Calciumcarbonat wird abfiltriert. Im Filtrat verbleibt das gut lösliche Natriumhydroxid. Dieser Prozess der Kaustifizierung wurde früher großtechnisch durchgeführt und ist auch heute wieder von Interesse.
Eine weitere Methode ist die stark exotherme Reaktion von elementarem Natrium mit Wasser unter Bildung von Natronlauge und Wasserstoff:
In der Schule wird dieser Versuch häufig gezeigt, um die Reaktivität der Alkalimetalle mit Wasser zu demonstrieren.
Nach dem Eindampfen der Natronlauge bleibt festes Natriumhydroxid zurück:
Das Acker-Verfahren zur Herstellung von Natriumhydroxid durch Schmelzflusselektrolyse von Natriumchlorid wurde von Charles Ernest Acker (1868–1920) in den Vereinigten Staaten von Amerika entwickelt.
Elektrolyse
Industriell wird Natriumhydroxid durch Elektrolyse von Natriumchlorid zu Natronlauge, Wasserstoff und Chlorgas hergestellt:
Es gibt dafür drei verschiedene Verfahrenstechniken:
- Amalgam-Verfahren
- Diaphragma-Verfahren
- Membranverfahren
Allen Verfahren gemein sind zusätzliche Reinigungs- und Aufkonzentrierungsstufen, um zu wasserfreiem Natriumhydroxid zu gelangen.
Da die Nachfrage nach Chlor seit den 1980er Jahren stagniert, deckt die als Nebenprodukt der Chloralkali-Elektrolyse entstehende Natronlauge den Weltbedarf nicht mehr vollständig, wodurch die Kaustifizierung wieder interessant wird.
Eigenschaften
Physikalisch-chemische Eigenschaften
Natriumhydroxid ist ein weißer hygroskopischer Feststoff und gehört zu den stärksten Basen. In Wasser löst es sich sehr gut unter großer Wärmeentwicklung durch die negative Lösungsenthalpie von −44,4 kJ/mol zur stark alkalisch reagierenden Natronlauge auf (pH 14 bei c = 1 mol/l). Es ist in wässriger Lösung stets vollständig dissoziiert. Doch machen sich bei höheren Konzentrationen die interionischen Kräfte zwischen den Natrium- und den Hydroxid-Ionen auf die freie Beweglichkeit der Ionen bemerkbar, sodass eine Normallösung (40 g Natriumhydroxid im Liter) zu etwa 78 %, eine 0,1-n-Lösung zu etwa 90 % dissoziiert erscheint. Mit dem Kohlenstoffdioxid der Luft reagiert es zu Natriumhydrogencarbonat und wird deshalb in luftdicht verschlossenen Behältern aufbewahrt. Um zu verhindern, dass das Natriumhydroxid Wasser aus der Luft bindet, kann man es gemeinsam mit einem Trockenmittel lagern. Das Hydroxid-Ion verdrängt als starke Base schwächere und flüchtige Basen aus ihren Salzen.
Kristallstruktur
Zwischen Raumtemperatur und Schmelzpunkt, 318,4 °C, kommt wasserfreies Natriumhydroxid in zwei Modifikationen vor. Unterhalb 299,6 °C (α-Modifikation) kristallisiert Natriumhydroxid mit einer orthorhombischen Kristallstruktur mit der Raumgruppe Cmcm (Raumgruppen-Nr. 63), darüber (β-Modifikation) niedriger symmetrisch mit einer monoklinen Kristallstruktur mit der Raumgruppe P21/m (Raumgruppen-Nr. 11). Das Natriumhydroxidmolekül ist linear und in dieser Reihenfolge parallel zur c-Achse angeordnet. Natrium und Sauerstoff bilden dabei in x,y ausgedehnte der Natriumchloridstruktur ähnliche Doppelschichten, wobei Natrium und Sauerstoff in den Richtungen (x-y) abwechselnd aufeinanderfolgen. Die Schichtdicke ist etwas größer als der Abstand von Natrium-Sauerstoff im Molekül. Längs c aufeinander folgende Schichten sind um 1/2 a verschoben. Die Gitterkonstanten sind bei 24 °C a = b = 3,3994 ± 0,001 Å, c = 11,377 ± 0,005 Å, α = β = γ = 90°. Das Molekül ist in der [010]-Ebene gewinkelt. Der Winkel β ist von der Temperatur abhängig. Mit steigender Temperatur wächst auch die Annäherung an den Typ der Natriumchlorid-Struktur, wie sie beim Natriumfluorid vorliegt. α-Natriumhydroxid ist häufig verzwillingt nach [110]. Die β-Modifikation ist stets zu ungefähr gleichen Volumenteilen nach [001] verzwillingt. Sie geht aus der α-Form durch Verschiebung der Schichten längs [100] hervor. Die Struktur der Doppelschichten bleibt dabei erhalten. Daneben kommt die Verbindung in mehreren Hydratformen vor. So sind das Mono-, Di-, 3,5-, Tetra-, Penta- und Heptahydrat bekannt. Die metastabile Form des Tetrahydrats β-NaOH·4H2O hat eine orthorhombische Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19) mit vier Formeleinheiten pro Elementarzelle und den Gitterkonstanten a = 6,237, b = 6,288, c = 13,121 Å bei −155 °C. Die Hydrate NaOH·3,5H2O und NaOH·7H2O haben jeweils eine Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit acht Formeleinheiten pro Elementarzelle (Gitterkonstanten a = 6,481, b = 12,460, c = 11,681 Å, β = 104,12° bei −100 °C) bzw. vier Formeleinheiten pro Elementarzelle (a = 7,344, b = 16,356, c = 6,897 Å, β = 92,91° bei −150 °C). Das Monohydrat schmilzt bei 64,3 °C, das 3,5-Hydrat bei 15,6 °C.
Reaktionen
Lagert man Natriumhydroxid unverschlossen an der Luft, reagiert es mit Kohlenstoffdioxid zu Natriumhydrogencarbonat oder Natriumcarbonat, daher wird es in luftdicht verschlossenen Behältern aufbewahrt.
Im Labor lässt sich Ammoniak einfach durch die Säure-Base-Reaktion aus Natriumhydroxid und Ammoniumchlorid herstellen.
Als Lösung reagiert es mit Aluminium (zu Aluminiumnatriumdioxid) und vielen anderen Metallen wie zum Beispiel Eisen, Kupfer, Cadmium, Cobalt und Titan.
Mit Säuren reagiert Natriumhydroxid zu Salzen, wobei die Wärmeentwicklung so beträchtlich ist, dass mit starken Säuren, z.B. beim Auftropfen von konzentrierter Schwefelsäure auf gepulvertes Natriumhydroxid, eine Explosion erfolgt.
Handelsform
Natriumhydroxid kommt in Kunststoffbehältern luftdicht verpackt in Form von kleinen Kügelchen oder als Plätzchen in den Handel.
Verwendung

Natriumhydroxid wird hauptsächlich in Form von Natronlauge verwendet und ist in der Industrie eine der wichtigsten Chemikalien. Zu deren Verwendung siehe dort.
Festes Natriumhydroxid ist neben Aluminiumspänen ein wesentlicher Bestandteil von Abflussreinigern. In Wasser gelöst oxidiert die starke Base unter Hitze- und Wasserstoffentwicklung das Aluminium und löst dann Fette und Proteine in den Ablagerungen durch Verseifung.
Mit heißer Lösung werden Brandschichten in Kochtöpfen gelöst. Natriumhydroxid ist nicht geeignet für Aluminiumtöpfe.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025
