Magnesiumchlorid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Magnesiumchlorid, MgCl2, ist das Magnesiumsalz der Salzsäure. Es bildet mehrere Hydrate.
Vorkommen

| Kristallstruktur | |
|---|---|
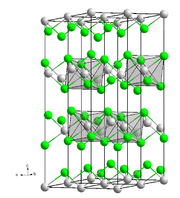 | |
| __ Mg2+ __ Cl− | |
| Allgemeines | |
| Name | Magnesiumchlorid |
| Andere Namen |
E 511 |
| Verhältnisformel | MgCl2 |
| Kurzbeschreibung | farblose, bitter schmeckende, zerfließliche, hexagonale Kristalle |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| ECHA-InfoCard | 100.029.176 |
| PubChem | 24584 |
| Eigenschaften | |
| Molare Masse |
|
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt |
|
| Siedepunkt |
1412 °C (wasserfrei) |
| Löslichkeit |
|
Magnesiumchlorid kommt in der Natur im Mineral Bischofit (MgCl2 • 6H2O) sowie als Doppelsalz Carnallit (KMgCl3 · 6 H2O) vor. Eine weitere natürliche Quelle ist das Meerwasser. In manchen Salzseen ist die Konzentration von Magnesium-Ionen sogar höher als die der Natrium-Ionen.
Gewinnung und Darstellung
Die technische Gewinnung von Magnesiumchlorid erfolgt durch Eindampfen der Endlaugen aus der Produktion von Kaliumchlorid. Dabei wird zuerst das Magnesiumchlorid-Hexahydrat (MgCl2 · 6H2O) erhalten. Weiteres Eindampfen liefert ein wasserärmeres Produkt. Wasserfreies Magnesiumchlorid wird durch Umsetzung von Magnesiumoxid mit Kohlenstoff und Chlor gewonnen:
Im Labor kann Magnesiumchlorid aus Magnesiumhydroxid und Salzsäure
oder durch Umsetzung von Magnesium mit Salzsäure
gewonnen werden.
Eigenschaften
Magnesiumchlorid ist stark hygroskopisch. Seine Neigung zur Hydrolyse ist weniger ausgeprägt als beim Aluminiumchlorid (AlCl3). Wasserfreies Magnesiumchlorid kristallisiert im CdCl2-Gittertyp. Die Standardbildungsenthalpie von Magnesiumchlorid beträgt −642 kJ/mol.
Die Verbindung bildet mit Methanol und Ethanol bei Raumtemperatur stabile Solvate. Mit Methanol wurden Solvate der Stöchiometrie 1:2, 1:3, 1:4, 1:6 und 1:8 bezogen auf Magnesiumchlorid und mit Ethanol Solvate der Stöchiometrie 1:2, 1:3, 1:4 und 1:6 bezogen auf Magnesiumchlorid hergestellt und charakterisiert.
Verwendung
Magnesiumchlorid wird zur Gewinnung von elementarem Magnesium mittels Schmelzflusselektrolyse genutzt:
Es wird zusammen mit Magnesiumoxid in Estrichzementen verwendet.
In der Lebensmitteltechnik wird Magnesiumchlorid als Säureregulator, Festigungsmittel, Geschmacksverstärker, Trägerstoff oder Trennmittel eingesetzt. Es ist in der Europäische Union als Lebensmittelzusatzstoff der Nummer E 511 ohne eine Höchstmengenbeschränkung (quantum satis) für alle für Zusatzstoffe zugelassenen Lebensmittel sowie auch für Öko-Lebensmittel zugelassen. Es ist der Hauptbestandteil des Gerinnungsmittels Nigari und dient so der Herstellung von Tofu. Es wird weiterhin als Streusalzergänzung verwendet.
Des Weiteren wird Magnesiumchlorid zur Anhebung der Magnesiumkonzentration in Riffaquarien verwendet.
Es wird auch zur Staubbindung (Explosionsschutz) im Steinkohlebergbau verwendet.
Zur Bindung von Straßenstaub wurde es versuchsweise in einer Antistaubit genannten Lauge verwendet.
Als Magnesium Oil, eine gesättigte Magnesiumchlorid-Wasser–Lösung mit öliger Konsistenz, wird es in konzentrierter Form in der Alternativmedizin zur transdermalen Magnesiumsubstitution (Aufnahme über die Haut) verwendet. Hierfür fehlen wissenschaftliche Belege.
Magnesiumchlorid-Hexahydrat kann als thermische Batterie Wärmeenergie speichern und wieder abgeben.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.08. 2024
