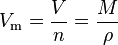Molares Volumen
| Physikalische Größe | |||||||
|---|---|---|---|---|---|---|---|
| Name | Molares Volumen | ||||||
| Formelzeichen der Größe | 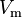 | ||||||
| |||||||
Das molare Volumen oder auch Molvolumen (Formelzeichen: Vm) eines Stoffes gibt an, welches Volumen ein Mol dieser Substanz einnimmt. Seine SI-Einheit ist m3/mol.
Es ergibt sich aus dem Quotienten des Volumens V und der Stoffmenge n, und kann aus der Molaren Masse M und der Dichte ρ der entsprechenden Substanz berechnet werden.
Es beschreibt also das Volumen, welches von insgesamt 6,022 · 1023 Teilchen (Avogadro-Konstante) einer Substanz ausgefüllt wird. Es handelt sich beim molaren Volumen um eine molare und damit intensive Größe, während das Volumen selbst eine extensive Größe darstellt.
Für Feststoffe und Flüssigkeiten hängt das molare Volumen vom jeweiligen Stoff ab (Stoffeigenschaft).
Molares Volumen des idealen Gases
Durch Umstellen der idealen Gasgleichung erhält man für das molare Volumen eines idealen Gases:
 ,
,
mit
- R die universelle Gaskonstante
- T die Temperatur und
- p der Druck.
Das molare Volumen eines idealen Gases beträgt damit nach derzeitiger Messgenauigkeit (unabhängig davon, welches Gas im Einzelnen vorliegt):
| Bedingungen | Druck | Temperatur | Molares Volumen | Anmerkung |
|---|---|---|---|---|
| Normbedingungen | 101,325 kPa | 0 °C | (22,413 968 ± 0,000 020) l/mol | "Normvolumen" |
| Chemische Std.bedingungen (IUPAC 1982) | 100,000 kPa | 0 °C | (22,710 953 ± 0,000 021) l/mol | |
| SATP-Bedingungen | 101,300 kPa | 25 °C | 24,465 433 l/mol. |
In der deutschen Norm DIN 1343, Ausgabe Januar 1990, ist das molare Normvolumen des idealen Gases noch mit dem älteren Wert von (22,414 10 ± 0,000 19) l/mol angegeben. Der ältere Wert überdeckt den jüngeren dank seiner größeren Unsicherheit völlig.
Für reale Gase gelten die aus dem idealen Gasgesetz erhältlichen Zahlen nur annähernd, und zwar auch nur bei geringem Druck und nicht zu geringen Temperaturen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.05. 2021