
Asparagin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Asparagin, abgekürzt Asn oder N, ist in der natürlichen L-Form eine der proteinogenen α-Aminosäuren.
Asparagin ist ein Derivat der Aminosäure Asparaginsäure, das statt deren γ-Carboxygruppe eine Amidgruppe trägt. Daher enthält die Seitenkette – im Unterschied zu Asparaginsäure – keine saure Gruppe, doch ist sie polar.
| Strukturformel | ||
|---|---|---|
| ||
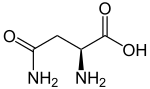
| Strukturformel des natürlich vorkommenden L-Asparagins | ||
| Allgemeines | ||
| Name | Asparagin | |
| Andere Namen |
| |
| Summenformel | C4H8N2O3 | |
| Kurzbeschreibung | farbloser Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 221-521-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Arzneistoffangaben | ||
| ATC-Code |
| |
| Eigenschaften | ||
| Molare Masse | 132,12 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,534 g/cm3 | |
| Schmelzpunkt |
| |
| pKS-Wert |
| |
| Löslichkeit | schlecht in Wasser (22 g/l bei 20 °C, Monohydrat, L-Asparagin) | |
Stereoisomerie
In biosynthetischen Proteinen kommt ausschließlich L-Asparagin [Synonym: (S)-Asparagin] neben anderen Aminosäuren peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Asparagin [Synonym: (R)-Asparagin], das in Proteinen nicht vorkommt. Racemisches DL-Asparagin [Synonym: (RS)-Asparagin] besitzt geringe Bedeutung.
Wenn „Asparagin“ in der Literatur ohne weiteren Namenszusatz (Deskriptor) erwähnt wird, ist gemeinhin L-Asparagin gemeint.
| Isomere von Asparagin | ||
| Name | L-Asparagin | D-Asparagin |
| Andere Namen | (S)-Asparagin | (R)-Asparagin |
| Strukturformel |  |
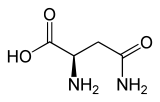
|
| CAS-Nummer | ||
| EG-Nummer | 200-735-9 | 218-163-3 |
| 221-521-1 (DL) | ||
| ECHA-Infocard | ||
| PubChem | ||
| DrugBank | - | |
| - (DL) | ||
Geschichte

L-Asparagin ist diejenige proteinogene Aminosäure, die zuerst entdeckt wurde. Der in Paris tätige Professor für Chemie und Pharmazie Louis-Nicolas Vauquelin beobachtete 1805 in einem von seinem Schüler Pierre-Jean Robiquet nach dem Eindampfen von Spargelsaft stehen gelassenem Rückstand die Ausscheidung zweier Kristalle.
Neben einer zuckerartigen Substanz konnten die beiden Franzosen eine salzartige Substanz isolieren, der sie den Namen Asparagin gaben, abgeleitet vom lateinischen Namen Asparagus für den Spargel. Ihre genaueren Ergebnisse veröffentlichten Vauquelin und Robiquet im darauffolgenden Jahr 1806.
Nach der Isolierung und Feststellung der Zusammensetzung vergingen jedoch weitere 57 Jahre bis zur finalen Strukturaufklärung. Erst 1862 gelang es Hermann Kolbe, die beiden Strukturformeln von Asparagin und Asparaginsäure eindeutig zu beschreiben.
Vorkommen
L-Asparagin ist Bestandteil zahlreicher Peptide (z. B. Insulin und Proteine). Größere natürliche Vorkommen finden sich im Spargel (Asparagus officinalis) und in den Keimlingen von Schmetterlingsblütlern und Kartoffeln.
Eigenschaften
Bereits seit Ende des 19. Jahrhunderts ist bekannt, dass nur eines der beiden Stereoisomere (D-Asparagin) süß schmeckt, und dies war für Louis Pasteur der Grund, auf „die chemische Asymmetrie der Nervensubstanz“ zu schließen. L-Asparagin schmeckt hingegen bitter.
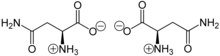
Asparagin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, wobei das Proton der Carboxygruppe sich an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe anlagert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genau genommen ist dies am isoelektrischen Punkt (IEP) der Fall, der bei Asparagin bei einem pH von 5,41 liegt. Bei diesem pH-Wert hat das Asparagin auch seine geringste Löslichkeit in Wasser.
Reaktionen
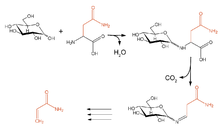
Wenn in einem Lebensmittel gleichzeitig Asparagin und reduzierende Zucker (z.B. Traubenzucker) vorliegen (vor allem bei Kartoffeln und Getreide), kann bei höheren Temperaturen und geringem Wassergehalt Acrylamid entstehen, das wegen seiner möglicherweise krebserzeugenden Wirkung in die Schlagzeilen geraten ist.
Biochemie
L-Asparaginsäure reagiert mithilfe der Asparaginsynthetase und Anlagerung eines Ammoniumions von Glutamin zu L-Asparagin. Adenosintriphosphat wird in dieser Reaktion als Energielieferant benötigt und reagiert dabei zu Adenosinmonophosphat und Pyrophosphat (PPi). Durch Hydrolyse von L-Asparagin entsteht wiederum L-Asparaginsäure.
Verwendung
Asparagin ist Bestandteil von Infusionslösungen zur parenteralen Ernährung.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.12. 2023