
Aluminiumhydrid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Aluminiumhydrid (Alan) ist eine chemische Verbindung aus den Elementen Aluminium und Wasserstoff mit der Verhältnisformel (AlH3)x. Es ist ein farbloses Pulver, welches oberhalb von 100 °C in seine Bestandteile zerfällt. Aluminiumhydrid ist außerordentlich feuchtigkeits- und oxidationsempfindlich. Es verbrennt explosionsartig an Luft und kann zur Speicherung von Wasserstoff in wasserstoffbetriebenen Fahrzeugen eingesetzt werden.
| Kristallstruktur | |
|---|---|
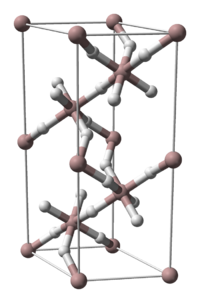 | |
| _ Al3+ _ H− | |
| Allgemeines | |
| Name | Aluminiumhydrid |
| Andere Namen |
|
| Verhältnisformel | (AlH3)x |
| Kurzbeschreibung | farbloses Pulver |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7784-21-6 |
| EG-Nummer | 232-053-2 |
| ECHA-InfoCard | 100.029.139 |
| PubChem | 14488 |
| ChemSpider | 13833 |
| Eigenschaften | |
| Molare Masse | 30,01 g/mol−1 |
| Aggregatzustand | fest |
| Dichte | 1,48 g/cm3 |
| Schmelzpunkt | 100 °C (Zersetzung) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −46,0 kJ/mol |
Eigenschaften
Von Aluminiumhydrid kennt man fünf kristalline Phasen (α, γ, δ, ζ), von denen bislang nur die Struktur der α-Phase erforscht wurde. Durch Einbau von Magnesium mit einem Massenanteil (veraltet Gewichtsprozent) von 0,01 bis 3 % kann die Vakuumstabilität von α-Aluminiumhydrid signifikant erhöht werden. Auch kann die Beständigkeit gegenüber Hydrolyse durch Tempern erhöht werden. So behandeltes α-Aluminiumhydrid wurde intensiv als energetischer Zusatz für Raketentreibstoffe und Sprengstoffe untersucht.
Synthese
Die Darstellung von Aluminiumhydrid erfolgt zweckmäßig durch die Umsetzung von Aluminiumchlorid mit Lithiumaluminiumhydrid in Diethylether:
Hierbei wird zunächst eine als Monomer anfallende Verbindung, das Etherat
gebildet, welche sich allmählich in das hochpolymere Aluminiumhydrid umwandelt.
Reaktionsverhalten
Aluminiumhydrid reagiert mit Wasser sehr stark unter Wasserstoff-Freisetzung gemäß:
Zusammen mit anderen Metallhydriden bildet Aluminiumhydrid Alanate. Wichtigster Vertreter ist das Lithiumaluminiumhydrid (Lithiumalanat):
Wegen seiner Unlöslichkeit hat es als Reduktionsmittel kaum Bedeutung.
Das Dimer Al2H6 ist isostrukturell zu Diboran (B2H6) und Digallan (Ga2H6).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.02. 2022

