Berylliumoxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK |
nicht festgelegt, da cancerogen | |||||||
Berylliumoxid (BeO, auch: Beryllerde) ist das Metalloxid des chemischen Elements Beryllium und ein giftiger Stoff, der unter anderem als keramisches Material eingesetzt wird.
| Kristallstruktur | ||
|---|---|---|
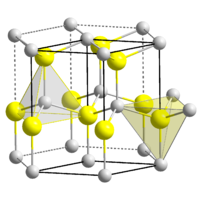
| ||
| _ Be2+ _ O2− | ||
| Allgemeines | ||
| Name | Berylliumoxid | |
| Andere Namen | Beryllerde | |
| Verhältnisformel | BeO | |
| Kurzbeschreibung | weißer, geruchloser Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 215-133-1 | |
| ECHA-InfoCard |
| |
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 25,01 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 3,01 g/cm3 | |
| Schmelzpunkt | 2575 °C | |
| Siedepunkt | ca. 3900 °C | |
| Löslichkeit | nahezu unlöslich in Wasser | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −609,4 kJ/mol | |
Vorkommen
Berylliumoxid kommt auch natürlich als Mineral vor und heißt dann Bromellit. Lagerstätten sind unter anderem in Långban, Schweden.
Gewinnung und Darstellung
Kommerziell wird Berylliumoxid seit ca. den 1950er Jahren hergestellt. Im primären industriellen Syntheseprozess wird technisch hochwertiges Berylliumhydroxid in Schwefelsäure gelöst. Die Lösung wird gefiltert, um unlösliche Oxid- und Sulfatverunreinigungen zu entfernen. Das entstehende klare Filtrat wird durch Verdampfung konzentriert und kristallisiert beim Abkühlen hochreines Berylliumsulfat. Dieses wird bei sorgfältig kontrollierten Temperaturen zwischen 1150 und 1450 °C kalziniert, die so ausgewählt wurden, dass sie den Berylliumoxidpulvern maßgeschneiderte Eigenschaften verleihen, die von den einzelnen Beryllia-Keramikherstellern gefordert werden.
Alternativ kann Berylliumoxid durch Reaktion von Beryllium mit Sauerstoff hergestellt werden.
Eigenschaften
Es hat neben den oben genannten Eigenschaften eine sehr hohe Härte und weist bei relativ geringer Dichte eine sehr hohe elektrische Durchschlagsfestigkeit auf was den Einsatz als elektrischer Isolator begründet. Weiters weist das Material eine sehr hohe Wärmeleitfähigkeit von 300 W/(K·m) auf.
Berylliumoxid wird besonders gut durch konzentrierte Säuren angegriffen. Es bildet, im Gegensatz zu anderen Erdalkalimetalloxiden, aufgrund der geringen Größe des Ions, eine Wurtzit-Struktur.
Verwendung

Anwendungen sind unter anderem in Thermoelement-Schutzrohren, Schmelztiegeln, Zündkerzen, in der Elektronik wegen seiner elektrischen Isolierung und gleichzeitig der hohen Wärmeleitfähigkeit zur Ableitung von Abwärme bei Halbleiterbauelemente und weiters in der Reaktortechnik verwendet (Beryllium ist ein exzellenter Neutronenmoderator und kann in Verbindung mit einem Alphastrahler als Neutronenquelle dienen). Als stöchiometrisch zusammen mit Aluminiumoxid gezüchteter und mit Chrom dotierter Einkristall wird Berylliumoxid unter dem Namen Alexandrit als Festkörperlaser-Material in der Medizin verwendet, welcher bei einer Wellenlänge von 755 nm emittiert.
Die keramischen Eigenschaften von gesintertem Berylliumoxid machen es geeignet für die Herstellung oder den Schutz von Materialien, die bei hohen Temperaturen in korrosiven Umgebungen eingesetzt werden. So wird es in Lasern und Elektronik (z.B. Transistorhalterungen, Halbleitergehäusen, mikroelektronischen Substraten, Mikrowellengeräten, Hochleistungslaserrohren), in der Luft- und Raumfahrt und militärischen Anwendungen (z.B. Gyroskope und Panzerungen), Feuerfestmaterialien (z.B. Thermoelementmanschetten und -tiegel), Kerntechnik (Reaktorbrennstoffe und Moderatoren) sowie medizinisch/zahnärztlichen Anwendungen (z.B. Keramikkronen) eingesetzt. Es wird auch als Additiv (zu Glas, Keramik und Kunststoffen) bei der Herstellung von Berylliumverbindungen und als Katalysator für organische Reaktionen verwendet. In der Dosimetrie wird Berylliumoxid als Detektormaterial von OSL-Dosimetern benutzt.
Toxizität
Aufgrund seiner Toxizität ist die Anwendung eingeschränkt, da das Material die Lungenkrankheit Berylliose auslösen kann und in Pulverform der Verdacht besteht krebserregend zu sein. In nicht pulverförmiger massiver Form ist Berylliumoxid zwar weitgehend gesundheitlich unbedenklich, es darf dabei aber keine Staubbildung, z.B. zufolge eines Abriebs, erfolgen. Auch das Recyceln von Komponenten welche Berylliumoxid enthalten, und es bei der Zerlegung zum Bruch des Materials und einer Staubbildung kommen kann, sind gefährlich. Die Verarbeitung des Materials wird daher seit den 1980er Jahren streng kontrolliert und Berylliumoxid enthaltende Bauteile und elektronische Bauelemente müssen gekennzeichnet sein. In vielen Bereichen wird es durch das ungiftige Bornitrid oder Aluminiumnitrid ersetzt, welche allerdings schlechtere Wärmeleitfähigkeiten aufweisen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.06. 2024

