
Bariumperoxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | 0,5 g/m3 (Barium) | |||||||
Bariumperoxid ist eine chemische Verbindung der Elemente Barium und Sauerstoff mit der Summenformel BaO2. Beim Erhitzen über 700 °C gibt BaO2 Sauerstoff ab. Bariumperoxid kann aufgrund seiner Verwandtschaft mit dem H2O2 als Oxidations- wie auch als Reduktionsmittel wirken.
| Kristallstruktur | |
|---|---|
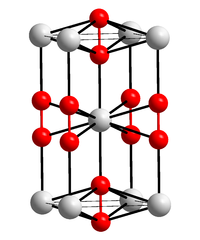 | |
| _ Ba2+ _–_ [O–O]2− | |
| Kristallsystem | tetragonal |
| Raumgruppe | I4/mmm (Nr. 139) |
| Allgemeines | |
| Name | Bariumperoxid |
| Andere Namen | Bariumsuperoxid |
| Verhältnisformel | BaO2 |
| Kurzbeschreibung | farbloser Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 215-128-4 |
| ECHA-InfoCard | 100.013.754 |
| PubChem | 14773 |
| Eigenschaften | |
| Molare Masse | 169,34 g/mol |
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt | 450 °C |
| Siedepunkt | Zersetzung bei > 700 °C |
| Löslichkeit |
|
Geschichte
Bariumperoxid ist die erste durch Alexander von Humboldt (1799) bekannt gewordene Peroxo-Verbindung.
Herstellung
Bariumperoxid wird durch Umsetzung von Bariumoxid mit Luft bei einem Druck von 2 bar und Temperaturen zwischen 500 °C und 600 °C hergestellt. Die Umsetzung verläuft mit einer Reaktionswärme von −143 kJ·mol−1 exotherm.
Im Labor kann es auch aus Bariumchloridlösung und Wasserstoffperoxid im Basischen gewonnen werden. Dabei entsteht zunächst das Octahydrat, das anschließend durch Erhitzen in Bariumperoxid umgewandelt werden kann.
Eigenschaften
Bariumperoxid ist ein sehr reaktionsfähiger brandfördernder weißer bis grauer Feststoff, der sich in Wasser zersetzt. Thermisch zersetzt sich Bariumperoxid oberhalb von 700 °C, wobei Sauerstoff und Bariumoxid entstehen. Bariumperoxid besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I4/mmm (Raumgruppen-Nr. 139). Das Oktahydrat kristallisiert ebenfalls tetragonal, jedoch in der Raumgruppe P4/mcc (Nr. 124).
Verwendung
Bariumperoxid wird hauptsächlich in der Pyrotechnik als Sauerstofflieferant und zur Erzeugung grüner Flammenfärbungen verwendet. Mit Magnesiumpulver findet es in Zündkirschen Anwendung. Auch dient es zum Entfärben von Bleigläsern und zum Bleichen von Stroh und Seide.
Früher spielte Bariumperoxid zur großtechnischen Herstellung von Wasserstoffperoxid (Brinsches Peroxid-Verfahren) eine große Rolle:
Erläuterung:
- Umwandlung des Sulfats in das Oxid, das SO2 wird zur Herstellung der im dritten Schritt benötigten Schwefelsäure eingesetzt.
- Synthese des Bariumperoxids
- Gewinnung des Wasserstoffperoxids; das BaSO4 wird als Rohstoff in den Kreislauf zurückgegeben
Heutzutage ist dieses Vorgehen praktisch vollständig vom energetisch weniger aufwändigen Anthrachinon-Verfahren verdrängt.
Ein weiteres historisches Verfahren, in dem Bariumperoxid als Zwischenprodukt genutzt wurde, war das Brinsche Sauerstoff-Verfahren zur technischen Darstellung von Sauerstoff. Im ersten Schritt wurde aus Bariumoxid BaO durch Erhitzen mit Luft, die von CO2 befreit worden war, Bariumperoxid hergestellt, wobei dieser Schritt der gleiche ist wie der zweite des obigen Peroxid-Verfahrens:
Nachdem der Luftstickstoff entfernt worden war, wurde dann das erhaltene Bariumperoxid entweder weiter erhitzt, bis es bei 800 °C den Sauerstoff wieder abgab, oder der Sauerstoff wurde bei 700 °C mit einer Vakuumpumpe abgezogen:
Der auf diese Weise gewonnene Sauerstoff war ca. 96%ig. Wie alle chemischen Verfahren, die ausschließlich zur Gewinnung von Sauerstoff dienen, hat es keine Bedeutung mehr, seit sich das Linde-Verfahren durchgesetzt hat.
Sicherheitshinweise
Beim Mischen von Bariumperoxid mit brennbaren Stoffen besteht Explosionsgefahr.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.11. 2022

