
Salpetersäure
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK |
| |||||||||
| Toxikologische Daten | 430 mg·kg−1 (LDLo, Mensch, oral) | |||||||||
Salpetersäure (nach der Nomenklatur der IUPAC Hydrogennitrat genannt) ist die bekannteste und stabilste Sauerstoffsäure des Stickstoffs. Der Name leitet sich vom Salpeter ab, aus dem sie durch Zugabe einer stärkeren Säure (Schwefelsäure) gewonnen werden kann.
Salpetersäure liegt in wässriger Lösung weitgehend dissoziiert vor. Als starke anorganische Säure zählt sie zu den Mineralsäuren. Ihre Salze und Ester heißen Nitrate. Die Salze werden auch mit dem Trivialnamen "-salpeter" gekennzeichnet, z.B.: Chilesalpeter, (Kali-)Salpeter, Ammonsalpeter, Kalksalpeter oder Mauersalpeter, Barytsalpeter etc.
Die reine Säure ist farblos und hat einen scharf stechenden Geruch. Sie wird unter anderem zur Herstellung von Düngemitteln, Farbstoffen und Sprengstoffen verwendet.
Geschichte
In der Schrift De inventione veritatis aus dem 12.Jahrhundert wird erwähnt, dass bereits im 9.Jahrhundert der arabische Alchimist Geber rohe Salpetersäure ("Aqua dissolutiva") durch trockenes Erhitzen von Salpeter (lat. sal petrae = Felsensalz; Kaliumnitrat KNO3), Cyprischem Vitriol (CuSO4·5 H2O) und Alaun (KAl(SO4)2·12 H2O) gewonnen haben soll. Im 13.Jahrhundert soll Albertus Magnus die Salpetersäure benutzt haben, um Gold und Silber zu trennen ("Scheidewasser"). Jedoch wurden viele Schriften Albertus Magnus nur zugeschrieben, um ihnen höheres Gewicht zu verleihen, wahrscheinlich auch die über die Verwendung der Salpetersäure. Später wurde Salpeter mit Eisenvitriol (FeSO4·7 H2O) erhitzt, was höhere Ausbeuten bei niedrigerer Temperatur lieferte.
J. R. Glauber gewann Mitte des 17.Jahrhunderts reinen spiritus nitri durch Umsetzung und Destillation von Salpeter mit Schwefelsäure, einem bis heute gebräuchlichen Laborverfahren zur Herstellung der Salpetersäure, die im Mittelalter auch aqua fortis oder aqua valens und im englischen Sprachraum strong water genannt wurde. Als Bestandteile der Salpetersäure erkannte A. L. Lavoisier Mitte des 18.Jahrhunderts die chemischen Elemente Stickstoffund Sauerstoff. Die genaue Zusammensetzung wurde von Henry Cavendish bestimmt, dem auch die Synthese aus dem Stickstoff der Luft durch elektrische Entladung gelang.
Eine rationelle Fabrikation begann erst Anfang des 19.Jahrhunderts, als billige Schwefelsäure und Chilesalpeter in ausreichenden Mengen verfügbar waren. Auch die "Luftverbrennung" in einem elektrischen Lichtbogen wurde zu einem großtechnischen Verfahren entwickelt (Birkeland-Eyde), das jedoch nur in Ländern mit billigem Strom konkurrenzfähig war. Die katalytische Oxidation von Ammoniak über Platin wurde von C. F. Kuhlmann (1838) entdeckt. Bis zur Erfindung der Ammoniaksynthese durch Haber und Bosch blieb jedoch Ammoniak zu teuer im Vergleich zu Chilesalpeter. Zu Beginn des 20.Jahrhunderts entwickelte Wilhelm Ostwald die Herstellung von Salpetersäure aus Ammoniak zur industriellen Reife. Die billige Ammoniak-Oxidation hat heute alle anderen großtechnischen Verfahren verdrängt.
| Strukturformel | |
|---|---|
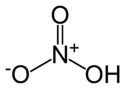 | |
| Allgemeines | |
| Name | Salpetersäure |
| Andere Namen |
|
| Summenformel | HNO3 |
| CAS-Nummer | 7697-37-2 |
| PubChem | 944 |
| Kurzbeschreibung | in reiner Form farblose Flüssigkeit, durch Licht oder Wärme teilweise Zersetzung zu Stickoxiden unter Gelb- bis Rotfärbung |
| Eigenschaften | |
| Molare Masse | 63,01 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 1,51 g/ml (20 °C) |
| Schmelzpunkt | -42 °C |
| Siedepunkt | 86 °C |
| Dampfdruck | 56 hPa (20 °C) |
| pKs-Wert | -1,37 |
| Löslichkeit | mit Wasser in jedem Verhältnis mischbar, heftige Reaktion mit Ethanol |
Herstellung
Salpetersäure wird technisch seit 1908 nach dem Ostwaldverfahren hergestellt. Es handelt sich dabei um die katalytische Oxidation von Ammoniak. Das Ammoniak-Luft-Gemisch wird rasch (1/1000 s Berührungszeit) durch heiße Platin-Rhodium-Netze (Katalysator) geleitet. Bei 800 °C entsteht Stickstoffmonoxid, das beim Abkühlen mit überschüssigem Sauerstoff zu Stickstoffdioxid und dann in Rieseltürmen mit Wasser zu etwa 60%iger Salpetersäure reagiert. Die 60%ige Salpetersäure kann durch Destillation bis 68 % konzentriert werden, was dem Azeotrop mit Siedepunktmaximum (122 °C) entspricht. Höhere Konzentrationen lassen sich durch Rektifikation (Entwässerung) mit Schwefelsäure (H2SO4) oder mit wässriger Magnesiumnitrat-Lösung (Mg(NO3)2) oder durch Behandlung von Distickstofftetroxid (N2O4) mit der stöchiometrisch nötigen Menge von Sauerstoff (bzw. Luft) und Wasser erreichen.
Im Labormaßstab kann Salpetersäure durch Umsetzung konzentrierter Schwefelsäure mit Nitratendargestellt werden. Vor 1908 wurde Salpetersäure durch dieses Verfahren unter Verwendung von Natriumnitrat (Chilesalpeter) gewonnen.
Oft auftretende Verunreinigungen der Säure mit Halogenen oder Halogenwasserstoffen lassen sich durch Zugabe von Silbernitrat und anschließende Destillation beseitigen. Wasserfreie Salpetersäure erhält man, von einer durch Destillation hochkonzentrierten Säure ausgehend, durch Durchleiten von Inertgas oder der Destillation über Phosphorpentoxid oder Oleum.
Eigenschaften

Salpetersäure ist in reinem Zustand farblos. Konzentrierte Salpetersäure zersetzt sich jedoch leicht (besonders unter Lichteinwirkung) und hat aufgrund des in ihr gelösten Stickstoffdioxids (NO2) oft einen gelblichen oder rötlichen Farbton. Reine Salpetersäure, die freies Stickstoffdioxid enthält, wird rauchende Salpetersäure genannt. Sie enthält über 90 % HNO3, wirkt stark oxidierend und kann manche leicht brennbaren Stoffe entzünden; daher gilt Salpetersäure ab 70 % als brandfördernd. Salpetersäure, die durch gelöstes Stickstoffdioxid gelb gefärbt ist, kann durch eine kleine Menge Harnstoff oder besser Harnstoffnitrat entfärbt werden.
Salpetersäure läst die meisten Metalle auf. Ausnahmen sind die Edelmetalle Gold, Platin und Iridium. Auch Aluminium, Titan, Zirconium, Hafnium, Niob, Tantalund Wolfram widerstehen der Auflösung durch Salpetersäure durch Passivierung. Dabei bildet sich auf dem Metall eine fest haftende, undurchlässige Oxidschicht. Da man somit Gold und Silber trennen konnte, wurde sie früher Scheidewasser genannt. Gemischt mit Salzsäure (Königswasser) oder Selensäure kann sie auch Gold und Platin auflösen. Weiter sind Aluminium und Eiseninfolge Passivierung resistent gegenüber kalter, Chrom gegenüber heißer Salpetersäure.
Salpetersäure färbt Eiweiße, die aromatische Aminosäuren wie L-Phenylalanin oder L-Tyrosin enthalten, unter Nitrierung des Benzolrings gelb. Diese Xanthoprotein-Reaktion kann zum Nachweis von aromatischen Aminosäuren und Eiweißen benutzt werden.
| Gew % HNO3 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Dichte (g/cm3) | 1,00 | 1,05 | 1,12 | 1,18 | 1,25 | 1,31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
| Viskosität (mPa·s) | 1,00 | 1,04 | 1,14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1,84 | 1,47 | 0,88 |
| Schmelzpunkt (°C) | 0 | -7 | -17 | -36 | -30 | -20 | -22 | -41 | -39 | -60 | -42 |
| Siedepunkt (°C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| Partialdruck p(HNO3) (mbar) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1,2 | 3,9 | 14,0 | 36,0 | 60,0 |
| Partialdruck p (H2O) (mbar) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6,5 | 3,5 | 1,2 | 0,3 | 0,0 |
| HNO3 (mol/l) | 1,7 | 3,6 | 5,6 | 7,9 | 10,4 | 13,0 | 15,8 | 18,5 | 21 | 24,01 |
Verwendung
Salpetersäure ist einer der wichtigsten Grundstoffe der chemischen Industrie. Sie dient:
- in Form ihrer Salze (Nitrate) als Düngemittel und für Explosivstoffe,
- als Salz Silbernitrat in der Fotoindustrie,
- als Scheidewasser zur Trennung (Quartation) von Gold und Silber (Silber wird aufgelöst)
- in Mischungen mit Salzsäure als Königswasser zum Auflösen von Gold sowie zum Vergolden und zum Nachweisen von Gold
- im Mischungsverhältnis 3 Teile Salzsäure zu 1 Teil Salpetersäure zum Aufschluss in der analytischen Chemie nach DIN EN 13 346 von Böden und Klärschlamm
- zum Beizen und Brennen von Metallen (grafische und galvanische Technik),
- zur Nitrierung von organischen Stoffen bei der Herstellung von Farbstoffen, Heilmitteln, Explosivstoffen und Desinfektionsmitteln,
- in Form ihrer Ester zur Herstellung von Explosivstoffen (Sprengöl), Celluloid, Nitro- und Zaponlacke,
- zum Verändern von Fetten (Wasserlöslichkeit) zum Zwecke der Reinigung,
- zum Polieren von Metallen.
- Als Bestandteil von Raketentreibstoffen / Oxidator
Gemische mit Schwefelsäure werden Nitriersäure genannt und zur Nitrierung von organischen Verbindungen verwendet.
Nachweis
Salpetersäure kann mittels Nitratnachweis durch die Ringprobe und durch Lunges Reagenz nachgewiesen werden. Diese Nachweisverfahren werden auch als klassische Verfahren bezeichnet.
Sicherheitshinweise
Salpetersäure wirkt auf Haut, Atemwege und Schleimhäute stark reizend und ist in der Lage lebendes Gewebe zu zerstören (Verätzung). In hoher Konzentration ist sie ein starkes Oxidationsmittel und brandfördernd.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.10. 2025


