Silane
Die Bezeichnung Silane steht nach den IUPAC-Regeln für eine Stoffgruppe chemischer Verbindungen, die aus einem Silicium-Grundgerüst und Wasserstoff bestehen. Ähnliche Stoffgruppen sind Germane und Alkane. Silane können einen verzweigten (iso- und neo-Silane) oder unverzweigten (n-Silane) Aufbau haben. Die allgemeine Summenformel der acyclischen (offenkettigen, auch catena-Silane genannten) Silane lautet SinH2n+2. Ringförmige Silicium-Wasserstoff-Verbindungen nennt man Cyclosilane (allgemeine Summenformel: SinH2n).
Geschichte
1857 stellten Friedrich Wöhler und Heinrich Buff bei der anodischen Zersetzung eines siliciumreichen Aluminiumstabes in verschiedenen Salzlösungen (Natrium-, Ammonium- oder Kaliumchlorid) mittels elektrischen Stroms erstmals eine gasförmige Siliciumwasserstoffverbindung (vermutlich Monosilan) her, welche der entstandene Wasserstoff als Verunreinigung enthielt und diesen bei Luftkontakt entzündete. Das Gasgemisch ließ sich einerseits über einer Salzlösung unverändert aufbewahren, explodierte aber unmittelbar bei Kontakt mit Luftsauerstoff mit leuchtender Flamme unter Bildung eines weißen Feststoffs, welchen Wöhler als Siliciumdioxid identifizierte. Das reaktive Gas aus dem Gemisch schied an einem erhitzen Platindraht unter Wasserstoffabspaltung festes Silicium ab. Der Versuch, durch Umsetzung von kristallinem Silicium unterhalb der Rotglut mit Chlorwasserstoffgas, diese neue Siliciumwasserstoff-Verbindung zu reproduzieren gelang Wöhler nicht, stattdessen synthetisierte er die ersten Chlorsilane. Im folgenden Jahr optimierte Wöhler die Synthese der Siliciumwasserstoffe dann durch Reaktion von Magnesiumsilicid (Mg2Si) mit konzentrierter Salzsäure.
1902 wurde der Gedanke der Siliciumwasserstoffe wieder aufgegriffen. Henri Moissan gelang der Nachweis von Monosilan und Disilan nach der Protolyse von Lithiumsilicid. Ab 1916 befasste sich Alfred Stock, zu dieser Zeit am Kaiser-Wilhelm-Institut für Chemie in Berlin-Dahlem, intensiv mit der Siliciumwasserstoffchemie und veröffentlichte innerhalb von 9 Jahren, großteils zusammen mit Carl Somieski, eine Schriftenreihe Siliciumwasserstoffe mit 16 Ausgaben. Durch Umsetzung von Magnesiumsilicid mit Säure, analog der Synthese von Wöhler, gelangen Stock und Somieski zunächst die Darstellung der niederen gasförmigen Silane Monosilan und Disilan sowie der Flüssigkeiten Trisilan und Tetrasilan. Seither werden diese Silane als „Stock’sche Silane“ bezeichnet. Stock gab der gesamten Stoffgruppe den allgemeinen Namen Silane. Auch wies er die Existenz von Pentasilan und Hexasilan nach und stellte verschiedene Halogensilane und daraus Siloxane her.
Alfred Stock entwarf zur Darstellung der Silane eine Glasapparatur, die das Arbeiten unter völligem Luftabschluss zuließ. Er benutzte einen Glaskolben, der halb mit wässriger Schwefelsäure gefüllt war, rührte diese Säure und schüttete das gemahlene, graue Magnesiumsilicid portionsweise dazu. Dabei zersetzte sich das Silicid unter Hitzeentwicklung und Bildung gasförmigen Wasserstoffs und Silanen. Die Gase leitete Stock nun in eine Glasapparatur, die er von außen kühlte. Die Kühlung war so eingestellt, dass der Wasserstoff und das Monosilan nicht kondensieren konnten. Er erhoffte sich durch die Kühlung, dass eventuell entstandene längerkettige Silane aufgrund ihrer höheren Siedepunkte kondensieren würden. Tatsächlich gelang es ihm, eine wasserklare Flüssigkeit zu gewinnen, die sich aus drei kettenförmigen Silanen zusammensetzte. Die weitere Derivatisierung dieser Verbindungen hatte jedoch keinen Erfolg.
Gewinnung und Darstellung
Silane werden im Wesentlichen auf drei grundsätzlichen Wegen hergestellt. In Form des sogenannten Rohsilans durch Zersetzung von Magnesiumsilicid (Mg2Si) unter sauren Bedingungen und Luftausschluss analog der Synthesen von Wöhler und Stock.
Durch die Reduktion der entsprechenden Halogensilane mit Lithiumhydrid oder Lithiumaluminiumhydrid in einem organischen Lösungsmittel, wie Diethylether. Über diesen Weg lassen sich die entsprechenden Silane SinH2n+2 mit n=1,2,3 selektiv und in hoher Ausbeute herstellen.
Der dritte Weg ist die Umsetzung von elementarem Silicium mit Halogenwasserstoff oder Alkylhalogeniden in der Gegenwart von Kupfer als Katalysator, ähnlich dem Verfahren von Wöhler, bei der Halogensilane oder Alkyhalogensilane entstehen.
Daneben sind Trisilan und höhere Silane in guter Ausbeute aus Monosilan mit Hilfe einer elektrischen Entladung zugänglich. Je nach Synthesebedingungen entstehen unter anderem Polysilen (SiH2)∞, das Silicium-Homologe zu den Alkenen, bzw. Polysilin (SiH)∞ (vergleiche dazu Alkine). Auch Verbindungen mit dazwischen liegender Stöchiometrie [(SiHn)∞, 1 ≤ n ≤ 2] und ringförmige Oligo- sowie Polysilane sind möglich.
Nomenklatur
Die Namensgebung erfolgt mit dem Wortstamm Sil und dem Suffix -an, analog zu den gesättigten aliphatischen Kohlenwasserstoffen die ebenfalls auf -an enden (Methan, Ethan, Propan, Butan und so weiter). Vorangestellt wird die Zahl der Siliciumatome als griechisches Zahlwort: Monosilan (ein Siliciumatom), Disilan (zwei Siliciumatome), Trisilan usw. Enthält ein Silan vier oder mehr Siliciumatome, so sind unterschiedliche Anordnungen, genauer Konstitutionen, denkbar. Man spricht von Konstitutionsisomerie. Zur weiteren Differenzierung stellt man je nach Aufbau des Moleküls dann einen der Deskriptoren n-, iso-, neo- oder cyclo- dem Verbindungsnamen voran.
Struktur und Eigenschaften
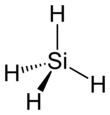
Silane sind die Silicium-Homologen der auf einem Kohlenstoff-Gerüst basierenden Alkane. Sie haben ähnliche physikalische Eigenschaften, wie Schmelzpunkt, Siedepunkt und Dipolmoment, wie die entsprechenden Alkane. Wie die gesättigten Kohlenwasserstoffe haben Silane in der Regel eine tetradhedrale Geometrie basierend auf einer sp3-Hybridisierung der Bindungsorbitale. Jedoch bestehen zwischen der Siliciumwasserstoff- und der Kohlenwasserstoff-Chemie grundlegende Unterschiede. Da Silicium elektropositiver als Kohlenstoff und Wasserstoff ist, sind die Bindungen in Silanen in der Regel stärker polarisiert als in den analogen Kohlenwasserstoff-Verbindungen. Die gebundenen Wasserstoffatome haben so einen elektronegativen Charakter und reagieren daher leicht mit acidem Wasserstoff. Die Si-H Bindungsenergie ist mit 378 kJ/mol deutlich geringer als die C-H Bindungsenergie mit 414 kJ/mol, wodurch Silane (thermisch) weniger stabil sind als Alkane.
Es existieren wesentlich weniger Silane, als es Kohlenwasserstoffe gibt. Bisher sind lediglich unverzweigte und verzweigte Silane mit bis zu 8 und cyclische Silane mit 5 oder 6 Siliciumatomen bekannt. Es handelt sich durchweg um farblose Gase oder Flüssigkeiten. Gegenüber den Stammverbindungen werden mehrkernige Silane durch Substitution mit Halogenen oder organischen Resten deutlich stabiler.
Homologe Reihe der linearen Silane
Die homologe Reihe der linearen, unverzweigten Silane ergibt sich aus der allgemeinen Formel H−(SiH2)n−H mit n = 1, 2, 3, … Die niedrigsten Silane – Monosilan und Disilan – sind gasförmig. Ab Trisilan nehmen die Silane einen flüssigen Aggregatzustand ein.
| Silan | Summenformel | Schmelzpunkt in °C |
Siedepunkt in °C |
Dichte in g/cm³ |
Molare
Masse in g/mol |
|---|---|---|---|---|---|
| Monosilan | SiH4 | −184,7 | −112,1 | 0,00135 | 32,12 |
| Disilan | Si2H6 | −129,4 | −14,8 | 0,00287 | 62,22 |
| Trisilan | Si3H8 | −116,9 | 52,9 | 0,739 | 92,32 |
| Tetrasilan | Si4H10 | −91,6 | 108,4 | 0,795 | 122,42 |
| Pentasilan | Si5H12 | −72,2 | 153,2 | 0,827 | 152,52 |
| Hexasilan | Si6H14 | −44,7 | 193,6 | 0,847 | 182,62 |
| Heptasilan | Si7H16 | −30,1 | 226,8 | 0,859 | 212,73 |
| Octasilan | Si8H18 | 242,83 |
Einzig das Monosilan ist bei Raumtemperatur unbegrenzt haltbar und das stabilste der Silane. Es zersetzt sich bei Abwesenheit von Katalysatoren erst bei 500 °C. Die höheren Homologen sind thermisch zunehmend weniger stabil und zersetzen sich bereits bei Raumtemperatur am Tageslicht unter Wasserstofffreisetzung und Bildung der kürzeren Homologen und anderer Polymerprodukte ((SiH< 2)x). Höhere Temperaturen führen zum Zerfall in die Elemente. Monosilan bildet sich entsprechend auch bei der Thermolyse der höheren Silane, sowie der substituierten Silane, wie Trichlorsilan oder Triethoxysilan.
Isomere und cyclische Silane
Ähnlich wie bei den Alkanen beobachtet man bei den höheren Silanen (ab Tetrasilan) auch das Auftreten von Konstitutionsisomeren. Es sind verzweigte und cyclische Silane bekannt. Die Konstitutionsisomere unterscheiden sich durch verschiedene physikalische Kenndaten wie Schmelz- und Siedepunkte.
| Silan | Summenformel | Strukturformel | Schmelzpunkt in °C |
Siedepunkt in °C |
Dichte | Molare
Masse in g/mol | |
|---|---|---|---|---|---|---|---|
| Verzweigte Verbindungen | |||||||
| iso-Tetrasilan | Si4H10 | 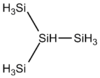 |
−99,4 | +101,7 | 0,793 | 122,42 | |
| iso-Pentasilan | Si5H12 | −109.8 | +146,2 | 0,820 | 152,52 | ||
| neo-Pentasilan | Si5H12 | −57,8 | +130 | - | 152,52 | ||
| Cyclische Silane | |||||||
| Cyclopentasilan | Si5H10 | 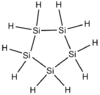 |
−10,5 | +194,3 | 0,963 | 150,51 | |
| Cyclohexasilan | Si6H12 | 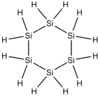 |
+16,5 | +226 | - | 180,61 | |
Chemische Reaktionen
Silane sind im Gegensatz zu den homologen Alkanen weniger beständig. Sie sind nur unter Luftabschluss synthetisierbar. Die niedrigen Silane SinH2n+2 (mit n= 1 bis 4) sind sehr reaktiv und können sich an der Luft selbst entzünden oder explodieren wobei sie zu Siliciumdioxid und Wasser verbrennen.
Die Reaktivität nimmt mit zunehmender Kettenlänge ab. Schon Pentasilan reagiert nicht mehr selbständig mit dem Sauerstoffanteil der Luft. Ab Heptasilan sind Silane nicht mehr spontan selbstentzündlich.
Silane sind dagegen weitgehend stabil gegenüber (sauerstofffreiem) Wasser und lassen sich daher über Salzlösungen längerfristig lagern. In Wasser mit einem pH-Wert oberhalb von 7 zersetzen sich Silane langsam zu Kieselsäure und Wasserstoff, während mit stark basischen Lösungen spontan und quantitativ Wasserstoff abgespalten wird. Dabei lässt sich die Reaktion so steuern, dass pro Si–H und Si–Si Bindung je ein Molekül Wasserstoff freigesetzt wird, wodurch die molare Zusammensetzung bestimmt werden kann.
Bei der Hydrolyse von Organosilanen handelt es sich um eine Reaktion erster Ordnung. Die Hydrolysegeschwindigkeit der Si-H-Bindung ist abhängig von der Art und Anzahl der organischen Reste. So ist die Hydrolyse von Trialkylsilanen deutlich langsamer als die von Triarylsilanen. Dies kann durch eine stärkere Erhöhung der Elektronendichte am Siliciumatom durch die Alkylgruppen erklärt werden. Entsprechend nimmt die Reaktionsgeschwindigkeit der Tri-n-Alkylsilane in der Reihe Ethyl, Propyl, Butyl ab. Bei den Trialkylsilanen reagieren die Silane mit n-Alkylresten um den Faktor 10 schneller als die analogen Silane mit verzweigten Alkyresten.
Mit Methanol reagiert Monosilan zu Di-, Tri- und Tetramethoxymonosilan aber nicht zur entsprechenden Monomethoxy-Verbindung.
Mit in Lösungsmitteln gelösten Alkalimetallen bilden sich die korrespondierenden Alkalisilylderivate. Dabei können je nach Lösungsmittel zwei konkurrierende Reaktionen ablaufen. Während in 1,2-Dimethoxyethan beide Prozesse ablaufen, läuft in Hexamethylphosphoramid nur die zweite Reaktion ab. In flüssigem Ammoniak als Lösungsmittel erfolgt dagegen Ammonolyse.
Mit lithiumorganischen Verbindungen bilden Silane die entsprechenden Alkylsilane, wobei die peralkylierten Silane bevorzugt entstehen.
Silane können auch mit Stickstoff reagieren, indem sie sich bei Temperaturen von etwa 500 °C zersetzen und das entstandene Silicium mit Stickstoff reagiert. Auch Mikrowellenstrahlung kann zur Zersetzung genutzt werden. Diese Reaktion wird beispielsweise zur Erzeugung dünner Siliciumnitrid-Schichten oder Siliciumnitrid-Nanokristalle verwendet.
Derivate der Silane
Derivate (Abkömmlinge) der Silane entstehen formal durch Austausch (Substitution) der Wasserstoffatome durch andere Elemente oder Gruppen. Hier sind insbesondere Halogene, Sauerstoff, Stickstoff und Kohlenstoff zu nennen.
Halogensilane
Bekannte Vertreter sind die Chlorsilane Monochlorsilan (SiH3Cl), Dichlorsilan (SiH2Cl2), Trichlorsilan (SiHCl3) und Tetrachlorsilan (SiCl4). Insbesondere das Trichlorsilan ist großtechnisch wichtig, da es leicht herstellbar ist und als Ausgangsstoff zur Herstellung von Monosilan, Dichlorsilan und hochreinem Silizummetall verwendet wird. Neben der Herstellung aus Silicium und Halogenwasserstoff nach der Vorschrift von Wöhler, lassen sie sich auch durch Umsetzung von Silanen mit wasserfreiem Halogenwasserstoff in Gegenwart von Aluminiumchlorid bei moderaten Temperaturen darstellen.
Während die Reaktion von Monosilan mit Chlor oder Brom bei Raumtemperatur explosionsartig verläuft, lässt sich diese bei niedrigeren Temperaturen kontrolliert durchführen.
Organosilane
Ersetzt man den Wasserstoff in den Silanen durch organische Reste, so erhält man siliciumorganische Verbindungen, die nach IUPAC als Silan-Derivate aufgefasst werden. Die Silicium–Kohlenstoff-Bindung ist sehr stabil und bereits 1917 berichtete Stock über die Existenz von mehr als 50 bekannten Tetraalkyl- und Tetraarylsilane. Diese sind thermisch stabil, beständig gegen Wasser und chemisch so stabil, dass sie sich am organischen Rest halogenieren, nitrieren oder sulfonieren lassen, ohne dass die Si–C-Bindung gespalten wird. Ein wichtiger Vertreter ist das weitgehend chemisch inerte Tetramethylsilan, welches als Standard in der Kernspinresonanzspektroskopie Verwendung findet. Aufgrund der Stabilität der Si–C-Bindung können auch Substanzen, wie Hexaphenyldisilan hergestellt werden, deren Kohlenstoffanalogon wie das Hexaphenylethan nicht existent sind. Organosilane lassen sich durch Umsetzung von Halogensilanen oder Silanen mit lithiumorganischen Verbindungen oder über eine Grignard-Reaktion herstellen.
Organohalogensilane werden großtechnisch mit der Müller-Rochow-Synthese hergestellt.
Silanole, Siloxane
Durch Hydrolyse – insbesondere von Halogensilanen – erhält man leicht die Silanole, welche, im Gegensatz zu den analogen Alkoholen, nicht sehr stabil sind. Sie polymerisieren unter Wasserabspaltung zu Siloxanen und Polysiloxanen, wobei Chlorwasserstoff die Polymerisation beschleunigt. Dabei bilden Monosilanole Dimere, Silandiole polymere Ketten und Silantriole dreidimensionale Netzwerke. Die Triebkraft ist die Bildung besonders stabiler Si–O–Si–Bindungen.
Verwendung
Trichlorsilan ist ein Zwischenprodukt zur Herstellung hochreinen Siliciums für integrierte Schaltkreise (Microchips), für Haftvermittler und zur Oberflächenvergütung. Auch durch die Thermolyse von Silanen in einer Wasserstoffatmosphäre erhält man hochreine Siliciumschichten (Siemens-Verfahren).
Aus Chlorsilanen und Chloralkylsilanen lässt sich durch Umsetzung in einer Knallgasflamme sogenannte pyrogene Kieselsäure erzeugen, die unter anderem ein wichtiger Füllstoff für Kunststoffe ist. Spezielle als funktionelle Organosilane bezeichnete Silane verwendet man zur Oberflächenfunktionalisierung, die auch kurz als Silanisierung bezeichnet wird. Silane aus der Reihe der Chlormethylsilane, insbesondere das Dichlordimethylsilan, werden als Ausgangsprodukte für die Herstellung von Silikonen eingesetzt.
Durch Oxidation von Dichlorsilan unter verringertem Druck lässt sich Siliciumdioxid in dünnen Schichten abscheiden.
Höhere, nicht mehr selbstentzündliche Silane wurden für ihre Verwendung als Raketentreibstoff diskutiert. Der hohe Preis sowie der im Vergleich zu Hydrazin oder Knallgasgemischen niedrigere spezifische Impuls sprechen gegen Silane. Allerdings könnten sich höhere, flüssige Silane wie Pentasilan als nichttoxische Additive zur Steigerung der Verbrennungseffizienz herkömmlicher Raketentreibstoffe eignen.
In der Halbleitertechnologie können mit einem geeigneten PECVD-Verfahren dielektrische Schichten aus Siliciumdioxid aus Monosilan und z.B. Stickstoffmonoxid hergestellt werden.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.07. 2024