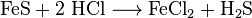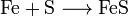Eisen(II)-sulfid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Kristallstruktur | |
|---|---|
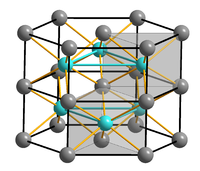 | |
| __ Fe2+ __ S2− | |
| Allgemeines | |
| Name | Eisen(II)-sulfid |
| Andere Namen |
Schwefeleisen Eisenmonosulfid |
| Verhältnisformel | FeS |
| CAS-Nummer | 1317-37-9 |
| Kurzbeschreibung | dunkelgraue oder schwarze, metallartige Stücke, Platten oder Stäbchen |
| Eigenschaften | |
| Molare Masse | 87,91 g/mol |
| Aggregatzustand | fest |
| Dichte | 4,84 g/cm3 |
| Schmelzpunkt | 1195 °C |
| Löslichkeit | praktisch unlöslich in Wasser |
Eisen(II)-sulfid (alte Bezeichnung: Schwefeleisen) ist das Sulfid des zweiwertigen Eisens mit der Formel FeS.
Eigenschaften

FeS ist unlöslich in Wasser. Mit Säuren reagiert es unter Bildung von Schwefelwasserstoff.
Beim Erhitzen auf höhere Temperaturen erfolgt bei 138 °C und 325 °C
jeweils eine kristallographische Umwandlung im festen Zustand.
Reines Eisen(II)-sulfid bildet hellbraune Kristalle
des Nickelarsenid-Typs.
Die technische Ware ist meist durch Resteisen dunkel bis schwarz gefärbt.
Herstellung
Sowohl im Labor als auch technisch lässt sich Eisen(II)-sulfid durch kurzes Erhitzen eines Gemisches aus Eisenpulver und Schwefelpulver in einer exothermen Reaktion herstellen:
Vorkommen
In der Natur findet sich Eisen(II)-sulfid als Pyrrhotin, Troilit und Mackinawit.
Die bakterielle anaerobe Korrosion kann man durch die Schwarzfärbung durch Eisen(II)-sulfid erkennen, welches als Endprodukt entsteht. Dieser archaische Stoffwechsel der Bakterien spielt in der Eisen-Schwefel-Welt, einem Szenario für die frühe Evolution des Lebens, eine wichtige Rolle.
Die Grünfärbung von Eigelb stammt von bei langem Kochen (länger als 10 Minuten) gebildetem - unschädlichen - Eisensulfid.
Verwendung
Eisen(II)-sulfid wurde früher für die Synthese der Schwefelsäure verwendet. Dabei wurde das Eisen(II)-sulfid unter Zufuhr von Luft geröstet, wobei das für die weitere Synthese benötigte Schwefeldioxid entstand. Im Labor kann Eisen(II)-sulfid zur Herstellung von Schwefelwasserstoff dienen.

© biancahoegel.de;
Datum der letzten Änderung : Jena, den: 16.05. 2023