Schwefelwasserstoff
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK | DFG/Schweiz: 5 ml/m3 bzw. 7,1 mg/m3 | |||||||||
Schwefelwasserstoff (auch Wasserstoffsulfid, Dihydrogensulfid, nicht zu verwechseln mit dem Hydrogensulfid-Anion HS−) ist eine chemische Verbindung aus Schwefel und Wasserstoff mit der Formel H2S. Schwefelwasserstoff ist ein übelriechendes, farbloses, hochgiftiges Gas. Es ist korrosiv, brennbar, leicht entzündlich und geringfügig schwerer als Luft. Es ist in Wasser wenig, in Ethanol etwas besser löslich. H2S ist eine sehr schwache Säure, deren Salze die Sulfide und Hydrogensulfide sind.
Schon in sehr geringen Konzentrationen ist Schwefelwasserstoff durch seinen typischen Geruch nach faulen Eiern zu erkennen. Er entsteht u.a. bei der Zersetzung von schwefelhaltigen Aminosäuren in den Proteinen von Eiklar und Dotter.
| Strukturformel | |
|---|---|
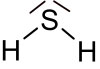 | |
| Allgemeines | |
| Name | Schwefelwasserstoff |
| Andere Namen |
|
| Summenformel | H2S |
| Kurzbeschreibung | farbloses, extrem toxisches, nach faulen Eiern riechendes Gas |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7783-06-4 |
| EG-Nummer | 231-977-3 |
| ECHA-InfoCard | 100.029.070 |
| PubChem | 402 |
| ChemSpider | 391 |
| Eigenschaften | |
| Molare Masse | 34,08 g/mol |
| Aggregatzustand | gasförmig |
| Dichte |
|
| Schmelzpunkt | −85,7 °C |
| Siedepunkt | −60,2 °C |
| Dampfdruck | 1,82 MPa (20 °C) |
| pKS-Wert |
|
| Löslichkeit |
|
| Dipolmoment | 0,97833 D (3,263 · 10−30 C · m) |
| Brechungsindex | 1,307 (16,85 °C) |
Vorkommen
In der Natur kommt Schwefelwasserstoff als sehr variabler Bestandteil (von Spuren bis zu 80 Vol-%) in Erdgas, als vulkanisches Gas und in Quellwasser gelöst vor. Er entsteht außerdem beim Abbau von Biomasse durch Fäulnis bzw. Verwesung (z.B. Tierkadaver, Leichen, Zersetzung der Laubstreu, Faulschlammbildung am Grund eutropher Seen usw.) oder bei Verdauungsvorgängen im Darm, den er mit dem Flatus verlässt. Der bei solchem Biomasseabbau entstehende Schwefelwasserstoff in Mülldeponien, Güllegruben, Abwasserhochdruckleitungen oder anderen technischen Einrichtungen verursacht in der Folge Schäden in Milliardenhöhe an Betonbauwerken (biogene Schwefelsäurekorrosion). Ein Verursacher des unangenehmen Mundgeruchs beim Menschen ist – neben anderen flüchtigen schwefelhaltigen organischen Verbindungen (Methanthiol, Dimethylsulfid) – Schwefelwasserstoff.
Gewinnung und Darstellung
Schwefelwasserstoff lässt sich labormaßstabmäßig herstellen, indem man im Kippschen Apparat Salzsäure auf Eisen(II)-sulfid tropfen lässt:
- Aus Eisen(II)-sulfid und Salzsäure entsteht Eisen(II)-chlorid und Schwefelwasserstoff.
Das so entstehende Produkt ist in der Regel durch Gase wie Wasserstoff und Luft verunreinigt. Bei Verwendung von natürlichem Eisensulfid (z.B. Pyrrhotin) kann das Produkt zusätzlich auch noch mit Spuren von Arsenwasserstoff, Monophosphan, Selenwasserstoff, Tellurwasserstoff und ähnlichem verunreinigt sein. Reiner Schwefelwasserstoff kann durch Erhitzen einer konzentrierten Magnesiumhydrogensulfid-Lösung oder aus den Elementen, aber auch aus Natriumsulfid und Phosphorsäure erhalten werden.
In der Petrochemie (Raffinerien) fällt Schwefelwasserstoff in großen Mengen bei der Hydrodesulfurierung von Erdöl an.
Eigenschaften
Physikalische Eigenschaften
- kritische Temperatur: 100,15 °C
- kritischer Druck: 89,7 bar
Thermodynamik:
S0g, 1 bar: 205,77 J/(mol·K)
In 1 l Wasser lösen sich bei Raumtemperatur bis zu 2,582 l Schwefelwasserstoffgas.
Schwefelwasserstoff ist geringfügig schwerer als Luft, unter Normalbedingungen beträgt der Dichteunterschied etwa 19 %.
Unter einem Druck von 18,2 bar verflüssigt sich Schwefelwasserstoff bei Raumtemperatur. Bei 90 GPa soll Schwefelwasserstoff in eine metallische Phase übergehen, die bei 203 K (−70 °C) Typ-II supraleitend wird; vermutet wird die Bildung der Ionen H3S+ und HS−.
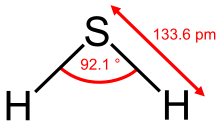
Das H2S-Molekül ist gewinkelt gebaut. Der Bindungswinkel beträgt 92,1° und der Kernabstand 133,6 pm. Wegen der geringen Elektronegativitätsdifferenz der Bindungspartner und somit geringen Bindungspolarität spielen Wasserstoffbrückenbindungen im Schwefelwasserstoff keine wesentliche Rolle, was sich im relativ niedrigen Schmelz- und Siedepunkt ausdrückt.
Chemische Eigenschaften
Mit einem pKs-Wert von 7,0 ist Schwefelwasserstoff eine sehr schwache Säure. Die wässrige Lösung reagiert mit vielen Schwermetallsalzen zu unlöslichen Sulfiden, was man sich im Kationentrennungsgang zunutze macht. Entsprechend wird das Gas mit Bleiacetatpapier nachgewiesen, da es mit Blei(II)-Ionen zu schwarzem Blei(II)-sulfid reagiert. Ebenso reagiert es mit Eisen(II)-Ionen zu schwarzem Eisen(II)-sulfid.
Die obige Reaktion zur Gewinnung ist auch umkehrbar. Unter natürlichen Bedingungen (pH 5–10) kann man Schwefelwasserstoff in wässriger Lösung mit Eisen(II)-chlorid zu Eisen(II)-sulfid binden.
Dies ist bei Biogas, Faulgas und im Abwasserkanal gängige Praxis. Man macht sich die große Affinität von Eisen zu Schwefel zunutze, um Biogas und Faulgas zu reinigen. Sonst würde bei Verbrennung von Biogas in Gasmotoren das entstehende Schwefeldioxid erhebliche Korrosionsprobleme verursachen.
Schwefelwasserstoff verbrennt bei reichlicher Luftzufuhr mit blauer Flamme zu Schwefeldioxid und Wasser, wobei unter anderem Schweflige Säure entsteht. Aus seiner wässrigen Lösung scheidet sich bei Luftzufuhr allmählich Schwefel ab (Autoxidation).
Mit Schwefeldioxid komproportioniert Schwefelwasserstoff in Anwesenheit von Wasserdampf zu Schwefel und Wasser (Redoxreaktion), mit geringen Mengen Chlor bilden sich Schwefel und Chlorwasserstoffgas. Schwefelwasserstoff ist zudem ein kräftiges Reduktionsmittel.
Schwefelwasserstoff ist in Wasser mäßig löslich. Die wässrige Lösung wird als Schwefelwasserstoffwasser bezeichnet. Schwefelwasserstoff dissoziiert in der wässrigen Lösung in sehr geringem Umfang (Dissoziation (Chemie)):
Die Dissoziation in der zweiten Stufe findet wegen der extrem kleinen Dissoziationskonstanten praktisch nicht statt. Die Möglichkeit, den Dissoziationsvorgang der ersten Stufe durch die Wahl des pH-Wertes der Lösung beeinflussen zu können, d.h. die Hydrogensulfid-Ionenkonzentration willkürlich einstellen zu können, ist die Grundlage für die analytische Trennung der Kationen nach dem H2S-Trennungsgang. Man muss dabei davon ausgehen, dass die Fällung von Metallsulfiden ein vielstufiger Prozess ist, bei dem die Aquakomplexe der Metall-Kationen zunächst einen Ligandenaustausch mit Hydrogensulfid-Ionen eingehen, wonach sich über viele mehrkernige Metallkomplexe schließlich die unlöslichen Sulfide bilden. Während die sich in saurer Lösung einstellende geringe Hydrogensulfidionen-Konzentration genügt, die besonders schwer löslichen Sulfide der Elemente der H2S-Gruppe auszufällen, werden die Löslichkeitsprodukte der etwas leichter löslichen Sulfide der Elemente der NH4HS-Gruppe erst in Ammoniaklösung erreicht. An der Luft verbrennt Schwefelwasserstoff je nach herrschenden Bedingungen zu Schwefel oder Schwefeldioxid (Claus-Verfahren). Mit Fluor setzt er sich explosionsartig zu Fluorwasserstoff und Schwefelhexafluorid um:
Sicherheitstechnische Kenngrößen
Schwefelwasserstoff bildet leicht entzündliche Gas-Luft-Gemische. Der Explosionsbereich liegt zwischen 4,3 Vol-% (60 g/m3) als untere Explosionsgrenze (UEG) und 45,5 Vol-% (650 g/m3) als obere Explosionsgrenze (OEG). Der maximale Explosionsdruck beträgt 5,9 bar. Die Grenzspaltweite wurde mit 0,83 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 270 °C. Der Stoff fällt somit in die Temperaturklasse T3.
Verwendung
Großchemie
Schwefelwasserstoff ist die Hauptquelle für elementaren Schwefel, welcher wiederum zu über 80 Prozent zu Schwefelsäure umgesetzt wird. Dazu wird zunächst ein Teil des Schwefelwasserstoffs zu Schwefeldioxid verbrannt:
Ein Teil des übrigen Schwefelwasserstoffs reagiert mit dem entstandenen Schwefeldioxid unter Komproportionierung zu elementarem Schwefel:
Chemische Analytik
Im klassischen Kationentrennungsgang wird H2S zum Ausfällen einer ganzen Gruppe benutzt (Schwefelwasserstoffgruppe). Durch Einleiten von H2S-Gas in schwach saure Lösungen fallen aus: As2S3, SnS2, Sb2S3, HgS, SnS, PbS, Bi2S3, CuS und bei Verdünnen mit Wasser auch CdS. Diese Kationen sind dann weiter aufzutrennen und mithilfe von Nachweisreaktionen zu identifizieren.
Wegen seiner Giftigkeit wird im Kationen-Trennungsgang zunehmend auf Schwefelwasserstoff verzichtet. Stattdessen werden die benötigten Hydrogensulfid-Anionen in situ erzeugt, zum Beispiel durch Hydrolyse von Thioacetamid, in kleineren Mengen auch durch Erhitzen von Schwefel mit Kerzenwachs.
H2S-Gang: Dieses Verfahren baut auf dem klassischen Trennungsgang auf. Durch spezifische Reagenzien werden chemisch ähnliche Kationen gruppenweise zur Fällung gebracht. Der Niederschlag wird in weiterer Folge aufgetrennt und analysiert, mit dem Überstand (der Lösung) wird weitergearbeitet und daraus die nächste Gruppe zur Fällung gebracht.
Toxikologie
Toxizität
Schwefelwasserstoff ist ein äußerst giftiges Gas, das sehr schnell zum Tod führen kann, was zahlreiche Berichte über Unfälle in der chemischen Industrie belegen. Durch seine etwas höhere Dichte als Luft sammelt sich das Gas am Boden.
Der charakteristische Geruch nach faulen Eiern (in faulen Eiern entsteht ebenfalls Schwefelwasserstoff) wird individuell bereits bei einer Konzentration von 0,0005 bis 0,13 ppm wahrgenommen und ist ein Vorteil gegenüber anderen tödlich wirkenden Gasen. Man gewöhnt sich jedoch an den Geruch und bei höheren Konzentrationen bleibt die Geruchswahrnehmung aus, da Schwefelwasserstoff die Eigenschaft hat, die Geruchsrezeptoren zu betäuben. An Ratten und Mäusen stellte man eine konzentrationsabhängige neurotoxische Schädigung am olfaktorischen Epithel (Nasenschleimhaut) bei Konzentrationen ab 30 ppm fest. Die maximale Arbeitsplatzkonzentration (MAK-Wert, ab 2006) beträgt 5 ppm.
Der Schwellwert für die Betäubung der menschlichen Geruchsrezeptoren liegt bei einer Konzentration von 200 ppm H2S.
Kurzzeitige Giftwirkung
Schwefelwasserstoff bildet bei Kontakt mit Schleimhäuten und Gewebeflüssigkeit im Auge, der Nase, des Rachens und in der Lunge Alkalisulfide, die sehr stark reizen. Eine Folge sind Wassereinlagerungen in der Lunge. Diese verschwinden gewöhnlich in wenigen Wochen.
Die Giftwirkung beruht auf der Zerstörung des roten Blutfarbstoffes Hämoglobin und damit der Lähmung der intrazellulären Atmung. Der Mechanismus ist bislang unklar. Vermutet wird, dass schwermetallhaltige, sauerstoffübertragende Enzyme inaktiviert werden. Der kleinere, nichtoxidierte Teil des Schwefelwasserstoffs kann dem zentralen und evtl. peripheren Nervensystem schaden.
Auf den Menschen ergeben sich folgende Wirkungen:
- ab 20 ppm: Hornhautschäden bei längerer Einwirkung
- ≈ 100 ppm: Reizung der Schleimhäute an Auge und Atemwegen, Speichelfluss, Hustenreiz
- > 200 ppm: Kopfschmerz, Atembeschwerden
- > 250 ppm: Betäubung der Geruchsrezeptoren
- > 300 ppm: Brechreiz
- ≈ 500 ppm: Kraftlosigkeit, Benommenheit, Schwindel
- > 500 ppm: Krämpfe, Bewusstlosigkeit
Langzeit-Einwirkung unter niedrigen Dosen kann zu Müdigkeit, Appetitlosigkeit, Kopfschmerzen, Gereiztheit, Gedächtnisschwäche und Konzentrationsschwäche führen.
Auf den Menschen ergeben sich konzentrationsabhängig Vergiftungserscheinungen:
- < 100 ppm: nach mehreren Stunden
- > 100 ppm: < 1 Stunde
- ≈ 500 ppm: lebensgefährlich in 30 Minuten
- ≈ 1000 ppm: lebensgefährlich in wenigen Minuten
- ≈ 5000 ppm (entspricht einem Volumenanteil von 0,5 %): tödlich in wenigen Sekunden
Bereits H2S-Konzentrationen von 0,1 % wirken nach wenigen Minuten tödlich. Bewusstlosigkeit tritt ab jener Konzentration schon durch einen oder mehrere Atemzüge ein.
In menschlichen Zellen hemmt bereits die Konzentration von 0,32 µmol/l an H2S in vitro die Zellatmung.
Langzeitwirkung
Tierversuche zeigen, dass Schweine, die mit schwefelwasserstoffhaltigen Nahrungsmitteln gefüttert wurden, nach einigen Tagen an Diarrhoe leiden und einen Gewichtsverlust nach etwa 105 Tagen zeigen.
Physiologie
Metabolismus
Schwefelwasserstoff entsteht im Körper kurzfristig beim Abbau eines Überschusses von Cystein mittels der Cystathionin-γ-Lyase (EC 4.4.1.1), die normalerweise Cystathionin zu Cystein abbaut, jedoch auch Cystein weiter abbauen kann:
In Ratten wurde eine weitere Reaktion desselben Enzyms nachgewiesen, die von Cystin ausgeht, beim Menschen aber keine Rolle spielt:
Das Gas verbindet sich schnell mit Thiolresten von in der Umgebung befindlichen Proteinen (-Cys wird zu -CySSH) und verändert dadurch deren biologische Aktivität. Insbesondere das Enzym Cytochrom-c-Oxidase wird dadurch deaktiviert. Der Großteil wird jedoch in den Mitochondrien über Thiosulfat und Sulfit zu Sulfat oxidiert, oder über Cysteinsulfinat zu Sulfit/Sulfat oder Taurin prozessiert.
Oxidation zu Sulfat
Mitochondrien schützen sich vor H2S beziehungsweise HS− durch dessen Oxidation zu Sulfat, die in drei Schritten stattfindet:
Zunächst wird H2S durch einen Enzymkomplex zu Thiosulfat oxidiert. Im Detail finden drei Einzelreaktionen statt, die durch die Enzyme Sulfid:Chinon-Oxidoreduktase (EC 1.8.5.-), Schwefeldioxygenase (EC 1.13.11.18) und Rhodanase katalysiert werden.
Ein Teil der Oxidation von Thiosulfat zu Sulfit geschieht mithilfe von Glutathion und dem Enzym Thiosulfatreduktase (EC 2.8.1.3), ein anderer Teil nutzt die Thiosulfat-Schwefeltransferase.
Zuletzt oxidiert die Sulfitoxidase Sulfit zu Sulfat. Eine Bestätigung des Abbauwegs ergab sich durch die Identifikation der mitochondrialen Schwefeldioxygenase mit dem ETHE1-Gen, das bei einer seltenen Mutation zu einer Erbkrankheit mit Schädigungen durch erhöhte H2S-Konzentrationen führt.
Funktion
Schwefelwasserstoff wirkt im Körper ähnlich wie Stickstoffmonoxid als Botenstoff und erweitert Blutgefäße (vasodilatativ). Es wird in Endothelzellen der Blutgefäße als auch in glatten Muskelzellen aus der Aminosäure L-Cystein gebildet. Wird Gefäßendothel über Muskarinische Acetylcholinrezeptoren stimuliert, wird H2S freigesetzt. Dies aktiviert in glatten Muskelzellen der Gefäßmuskulatur spannungsaktivierte und kalziumaktivierte Kaliumkanäle. Dadurch kommt es zur Hyperpolarisation glatter Muskelzellen und letztlich zur Erweiterung der Blutgefäße (Vasodilatation).
Anwendung
Schwefelwasserstoff könnte möglicherweise als Mittel gegen Erektionsstörungen Anwendung finden. Es wird natürlich in den Schwellkörpern des Penis und der glatten Muskulatur der Penis-Arterie gebildet. Versuche zeigten, dass sowohl L-Cystein als auch Schwefelwasserstoff(-Salz) extern zugeführt eine konzentrationsabhängige Erektion in den Penisschwellkörpern (Corpora cavernosa penis) verursachen.
In niedriger Konzentrationen bremst Schwefelwasserstoff bei Mäusen Stoffwechselvorgänge und senkt die Körpertemperatur ab. Der winterschlafähnliche Zustand ist voll reversibel und für die Tiere unschädlich. Untersucht wird daher, ob man damit bei Transplantationen die Qualität und Überlebenszeit von zur Transplantation vorgesehenen Organen steigern kann. Auch wird in Humanstudien geprüft, ob Schwefelwasserstoff die Überlebenswahrscheinlichkeit von Notfallpatienten verbessern, um durch Inhalation bzw. Injektion von H2S den Stoffwechsel zu verlangsamen und den Sauerstoffbedarf zu reduzieren. Im Idealfall könnte dies der Rettungsdienst präklinisch vornehmen.
Gemäß einer Studie von 2007 an der University of Alabama at Birmingham, die im Fachblatt Proceedings of the National Academy of Sciences erschien, verursacht Schwefelwasserstoff sehr gering dosiert vermutlich die gesundheitliche Wirkung von Knoblauch, da Knoblauch Risiken für Herzerkrankungen durch Bluthochdruck, erhöhte Blutfette und andere Faktoren senkt. In Bevölkerungsgruppen, die viel Knoblauch verzehren, gebe es weniger Probleme mit zu hohem Blutdruck.
Analytik
Sowohl die Toxizität als auch seine biologische Relevanz stellen hohe Anforderungen an die Analytik von Schwefelwasserstoff. Im Gegensatz zur oben erwähnten Verwendung von H2S im anorganischen Trennungsgang werden hier instrumentelle, quantitative Nachweisverfahren für H2S vorgestellt.
Instrumentelle Analytik
Optische Bestimmung
Die am häufigsten verwendete chromogene Reaktion für den photometrischen Nachweis von H2S und Sulfiden ist die Reaktion mit N',N-Dimethyl-p-phenylendiamin zum Methylenblau. Dabei werden Eisen(III)-Salze als Katalysator verwendet. Das Reaktionsprodukt weist ein Absorptionsmaximum bei 670 Nanometer auf und kann photometrisch bestimmt werden.
Elektroanalytik
Amperometrie
Weit verbreitet sind amperometrische H2S-Sensoren. Bei der Amperometrie wird an eine Arbeitselektrode ein Potential angelegt und der resultierende Strom gemessen; dieser ist proportional zur Konzentration des H2S. Schwefelwasserstoff wird dabei zum Sulfat oxidiert. Mit Kohlenstoffnanoröhren modifizierte Elektroden erzielten bei einem Oxidationspotential von 100 mV eine Nachweisgrenze von 0,3 µmol/l. Die Bauart der verwendeten Elektroden ist eng verwandt mit der der Clark-Elektrode zur Sauerstoffbestimmung.
Potentiometrie
Für die Sensorik von gasförmigem H2S wurden auch potentiometrische Sonden entwickelt. Als Beispiel können Feststoffelektrolyt-basierte, galvanische Halbzellen genannt werden, die zusammen mit H2S eine elektromotorische Kraft liefern, die gemessen wird. Mit Yttriumoxid-stabilisierten Zirkoniumröhren als Sensor konnten H2S-Konzentrationen in Luft bis 0,2 ppm mit zuverlässiger Reproduzierbarkeit gemessen werden. Unter Verwendung von Hexacyanoferrat als Redoxpartner konnten sogar 30 ppb H2S nachgewiesen werden.
Gaschromatographie
Für die Analytik von gasförmigen Substanzen ist häufig die Gaschromatographie die erste Wahl. Nach erfolgter Trennung können Schwefelverbindungen wie H2S flammenphotometrisch bei einer Emissionswellenlänge von 397 Nanometer detektiert werden. Ein Verfahren zum schnellen Spurennachweis von Schwefelwasserstoff in Kohlegas erzielte eine Nachweisgrenze von 10 ppb.
Siehe auch
Literatur
- Dieter Weismann, Manfred Lohse (Hrsg.): Sulfid-Praxishandbuch der Abwassertechnik. Vulkan, Essen 2007, ISBN 978-3-8027-2845-7.
- Tatjana Hildebrandt, Manfred K. Grieshaber: Die vielen Seiten des Sulfids. Tödlich und doch lebensnotwendig. In: Biologie in unserer Zeit. Band 39, Nr. 5, 2009, S. 328–334, doi: 10.1002/biuz.200910403.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.02. 2026