
Lanthan
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Lanthan [lanˈtaːn] ist ein chemisches Element mit dem Elementsymbol La und der Ordnungszahl 57. Es zählt zu den Übergangsmetallen sowie den Metallen der seltenen Erden, im Periodensystem steht es in der 6. Periode und der 3. Nebengruppe (Gruppe 3) oder Scandiumgruppe. Meist wird es auch zu den Lanthanoiden gezählt, auch wenn die f-Schale des Elementes unbesetzt ist.
Geschichte
Lanthan (griech. λανθάνειν, lanthanein, „verborgen sein“) wurde 1839 vom schwedischen Chemiker und Chirurg Carl Gustav Mosander entdeckt. Aus einem vermeintlich reinen Cernitrat gewann er durch fraktionierte Kristallisation Lanthansulfat.
Vorkommen
Lanthan kommt natürlich nur in chemischen Verbindungen vergesellschaftet mit anderen Lanthanoiden in verschiedenen Mineralien vor. Hauptsächlich sind dies:
- Monazit ((Ce, La, Th, Nd, Y)PO4)
- Bastnäsit ((Ce, La, Y)CO3F)
Gewinnung und Darstellung
Nach einer aufwendigen Abtrennung der anderen Lanthanbegleiter wird das Oxid mit Fluorwasserstoff zum Lanthanfluorid umgesetzt. Anschließend wird dieses mit Calcium unter Bildung von Calciumfluorid zum Lanthan reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum.
Eigenschaften

Physikalische Eigenschaften
Das silberweiß glänzende Metall ist hämmerbar und plastisch verformbar (duktil). Es existieren drei metallische Modifikationen.
Chemische Eigenschaften
Lanthan ist unedel. Es überzieht sich an der Luft rasch mit einer weißen Oxidschicht, die in feuchter Luft zum Hydroxid weiterreagiert.

- Lanthan reagiert mit dem Sauerstoff der Luft zu Lanthanoxid, mit Wasser weiter zu Lanthanhydroxid.
Bei Temperaturen oberhalb von 440 °C verbrennt Lanthan zu Lanthanoxid (La2O3). Unter Bildung von Wasserstoff erfolgt in kaltem Wasser eine langsame, in warmen Wasser eine rasche Reaktion zum Hydroxid.

- Lanthan in Wasser erzeugt Lanthanhydroxid und Wasserstoff.
In verdünnten Säuren löst sich Lanthan unter Wasserstoffentwicklung auf.

- Lanthan und Schwefelsäure reagieren zu Lanthansulfat und Wasserstoff.
Mit vielen Elementen reagiert es in der Wärme direkt, mit Halogenen schon bei Raumtemperatur. Lanthan und Wasserstoff bilden ein schwarzes, wasserempfindliches unstöchiometrisches Hydrid.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Lanthan, La, 57 |
| Serie | Übergangsmetalle |
| Gruppe, Periode, Block | 3, 6, d |
| Aussehen | silbrig weiß |
| CAS-Nummer | 7439-91-0 |
| Massenanteil an der Erdhülle | 17 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Modifikationen | 3 |
| Kristallstruktur | hexagonal |
| Dichte | 6,17 g/cm3 (20 °C) |
| Mohshärte | 2,5 |
| Magnetismus | paramagnetisch
(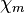 = 5,4 · 10−5)
= 5,4 · 10−5) |
| Schmelzpunkt | 1193 K (920 °C) |
| Siedepunkt | 3743 K (3470 °C) |
| Molares Volumen | 22,39 · 10−6 m3/mol |
| Verdampfungswärme | 400 kJ/mol |
| Schmelzwärme | 6,2 kJ/mol |
| Schallgeschwindigkeit | 2475 m/s |
| Elektrische Leitfähigkeit | 1,626 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 13 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 3 |
| Oxide (Basizität) | La2O3 (schwach basisch) |
| Normalpotential | −2,38 V (La3+ + 3 e− → La) |
| Elektronegativität | 1,1 (Pauling-Skala) |
Verwendung
Lanthan ist Bestandteil im Mischmetall. Pyrophore Werkstoffe für Zündsteine enthalten 25 bis 45 Gewichtsprozent Lanthan. Darüber hinaus findet es Verwendung als Reduktionsmittel in der Metallurgie. Als Gusseisenzusatz unterstützt es die Bildung von Kugelgraphit, als Legierungszusatz bewirkt es eine Verbesserung der Oxidationsbeständigkeit. Lanthanbeimengungen reduzieren die Härte und Temperaturempfindlichkeit von Molybdän.
Hochwertige Kathoden zur Erzeugung von freien Elektronen bestehen aus Lanthanhexaborid als Ersatz für Wolframdraht. Hochreines Lanthanoxid wird in der Glasindustrie zur Herstellung hochwertiger Gläser mit hohem Brechungsindex für die Optik z. B. für Kameralinsen benutzt.
Als Legierung
- mit Cobalt:
Die Cobalt-Lanthan-Legierung LaCo5 wird als Magnetwerkstoff, lanthandotiertes Bariumtitanat zur Herstellung von Kaltleitern (temperaturabhängige Widerstände) verwendet. In Verbindung mit Cobalt, Eisen, Mangan, Strontium u.a. dient es als Kathode für Hochtemperatur-Brennstoffzellen (SOFC). „Verunreinigtes“ Lanthan-Nickel (LaNi5) findet als Wasserstoffspeicher in Nickel-Metallhydrid-Akkumulatoren Verwendung.
- mit Titan:
Einem Legierungsmetall mit Materialzusammensetzungen aus Lanthan und Titan wird die Wirkung zugeschrieben, dass bei spanbildender Verarbeitung die Spanlänge reduziert wird. Dadurch soll die Bearbeitung des Metalls erleichtert werden.
Im Bereich der Medizin werden aus dem Legierungsmetall korrosionsbeständige und gut sterilisierbare Instrumente hergestellt. Diese Metalllegierung mit Titan soll für Werkzeuge und Apparate für chirurgische Eingriffe besonders gut geeignet sein, da die Allergie-Neigung bei Verwendung derartiger Metalllegierung mit Titan im Verhältnis zu anderen Legierungen gering sein soll.
Als Lanthanoxid
- In optischem Glas (Lanthankron) bewirkt Lanthanoxid einen hohen Brechungsindex und eine geringe Dispersion. Diese Gläser kommen in optischen Geräten, wie Kameras, Teleskopen, oder Brillen zum Einsatz.
- In Essgeschirr, etwa Weingläsern und in der Glasur von Porzellan ersetzt Lanthanoxid giftigere Bleiverbindungen. Außerdem verbessert es die chemische Beständigkeit gegen Laugen. Das Geschirr wird „spülmaschinenfest“.
- Katalysatorzusatz an Zeolithen beim Fluid Catalytic Cracking in der Raffinerie zur Erdölverarbeitung
- Herstellung keramischer Kondensatormassen und silikatfreier Gläser
- Bestandteil von Glaspoliermitteln
- Herstellung von Glühkathoden für Elektronenröhren (auch Lanthanboride)
Als Lanthancarbonat
- Medikament zur Senkung des Phosphatspiegels bei Dialysepatienten (sog. Phosphatbinder)
Sicherheitshinweise
Lanthan wird als wenig toxisch eingestuft. Eine letale Dosis ist bisher unbekannt. Jedoch gilt Lanthan-Pulver als stark ätzend, weil es sehr leicht durch z.B. Hautfeuchtigkeit zu basischem Lanthanhydroxid reagiert (ähnlich den Elementen Calcium und Strontium). Die letale Dosis beträgt bei Ratten 720 mg.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.01. 2024

