Schwefelhexafluorid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | Schweiz: 1000 ml/m3 bzw. 6000 mg/m3 | ||||||
| Treibhauspotential | 22.800 (bezogen auf 100 Jahre) | ||||||
Schwefelhexafluorid ist eine anorganische chemische Verbindung aus den Elementen Schwefel und Fluor mit der Summenformel SF6. Es ist unter Normalbedingungen ein farb- und geruchloses, ungiftiges Gas, das unbrennbar ist und sich äußerst reaktionsträge, ähnlich wie Stickstoff, verhält. Bei Normaldruck und einer Temperatur von −63,8 °C geht Schwefelhexafluorid durch Sublimation direkt vom festen in den gasförmigen Zustand über.
Gewinnung und Darstellung
Schwefelhexafluorid kann direkt aus den Elementen durch Umsetzung elementaren Schwefels (S8) im Fluorgasstrom (F2) synthetisiert werden. Die Reaktion verläuft stark exotherm.
Neben SF6 bilden sich bei diesem Syntheseweg auch weitere Schwefelfluoride, wie Dischwefeldecafluorid (S2F10). Daher wird bei der technischen Herstellung das Gas auf 400 °C erhitzt, wodurch eine Disproportionierung von Dischwefeldecafluorid in Schwefelhexafluorid und Schwefeltetrafluorid (SF4) erfolgt.
Durch Waschen des Gasgemisches in Lauge wird das Schwefeltetrafluorid zerstört, während SF6 durch die Lauge nicht angegriffen wird.
Durch anschließende Druckdestillation wird das reine SF6 abgetrennt.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Schwefelhexafluorid | |
| Andere Namen |
| |
| Summenformel | SF6 | |
| Kurzbeschreibung | farb- und geruchloses Gas | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 2551-62-4 | |
| EG-Nummer | 219-854-2 | |
| ECHA-InfoCard | 100.018.050 | |
| PubChem | 17358 | |
| ChemSpider | 16425 | |
| Eigenschaften | ||
| Molare Masse | 146,05 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte | 6,63 kg/m3 (0 °C, 1013 hPa) | |
| Sublimationspunkt | −63,8 °C | |
| Dampfdruck | 2,11 MPa (20 °C) | |
| Löslichkeit | sehr schlecht in Wasser (40 mg/l) | |
| Dipolmoment | 0 | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −1220 kJ/mol | |
Eigenschaften
Physikalische Eigenschaften
Schwefelhexafluorid ist unter Normalbedingungen gasförmig. Es hat eine etwa fünfmal so hohe Dichte wie Luft. Sein Sublimationspunkt liegt bei −63,8 °C.
Der Tripelpunkt liegt bei einer Temperatur von −50,8 °C und bei einem Druck von 2,26 bar. Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich.
Der kritische Punkt liegt bei einer Temperatur von 45,6 °C, einem kritischen Druck von 3,76 MPa und einer kritischen Dichte von 0,735 g/cm3.
Die Verdampfungsenthalpie von Schwefelhexafluorid beträgt bei einem Druck von 1013 hPa 115 kJ/kg.
Kristall- und Molekülstruktur
Bei tiefen Temperaturen kristallisiert es im monoklinen Kristallsystem.
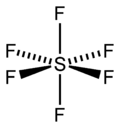
Im gasförmigen Zustand ist das SF6-Molekül oktaedrisch (Oh); die S–F-Bindungslänge beträgt 156,1 pm.
-
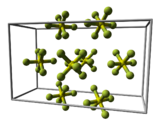 Elementarzelle des Schwefelhexafluorids
Elementarzelle des Schwefelhexafluorids -
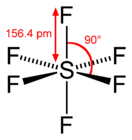 Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid
Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid
Chemische Eigenschaften
Aufgrund seiner Struktur ist es praktisch chemisch inert und verhält sich daher ähnlich wie molekularer Stickstoff oder die Edelgase. Es ist nahezu unlöslich in Wasser und nicht entflammbar.
Auf Grund seiner Inertheit sind Reaktionen in der Regel nur unter drastischeren als der Normalbedingung durchführbar. So setzt sich Natrium mit SF6 in flüssigem Ammoniak zu Natriumsulfid und Natriumfluorid um:
.
In Gegenwart von Schwefelwasserstoff ist die Komproportionierung zu elementarem Schwefel und Fluorwasserstoff (HF) bekannt:
.
SF6 ist isoelektronisch zu den Anionen Hexafluorophosphat (PF6−), Hexafluorosilicat (SiF62−) und Hexafluoroaluminat (AlF63−).
Verwendung

Schwefelhexafluorid (SF6) wird als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt, beispielsweise in gasisolierten Schaltanlagen (GIS) mit Hochspannungsschaltern und beigasisolierten Rohrleitern (GIL) in komplett gekapselten Anlagen mit Betriebsspannungen von 6 kV bis 800 kV. Gegenüber Freiluftschaltanlagen wird deutlich Platz eingespart und die Einflüsse von Witterung und Vögeln oder Nagetieren werden vermieden. SF6 dient dabei auch als Löschgas, um den Schaltlichtbogen in Leistungsschaltern zu unterbrechen.
Die Durchschlagsfestigkeit ist bei Normaldruck fast dreimal so hoch wie in Luft oder Stickstoff. Diese Eigenschaften sowie die geringen dielektrischen Verluste prädestinieren es zur Verwendung als Isoliergas in Koaxialkabeln und gasisolierten Hochfrequenz-Leistungskondensatoren, die damit kleiner gebaut werden können. Als Isolationsgas in elektrischen Schaltanlagen wird es unter erhöhtem Druck von 5 bar bis 10 bar gehalten, um die nötige hohe Isolationsfähigkeit sicherzustellen. Der erhöhte Gasdruck ist deshalb notwendig, weil damit die mittlere Weglänge der freien Elektronen im Gas zufolge des Paschen-Gesetzes reduziert wird. Dadurch können Elektronen nicht so stark beschleunigt werden wie bei Normaldruck, denn sie stoßen früher mit den SF6-Molekülen zusammen.
In Schaltanlagen mit dem prinzipiell ungiftigen SF6-Gas entstehen im Laufe des Betriebes durch die Lichtbögen in Kombination mit Verunreinigungen wie einem geringen Wasseranteil neben dem ungiftigen Tetrafluormethan giftige Fluorid-Verbindungen wie Fluorwasserstoff und Thionylfluorid sowie das hochgiftige Dischwefeldecafluorid (S2F10). Aus diesen Gründen müssen in gasdichten SF6-Schaltanlagen vor Wartungsarbeiten entsprechende Sicherheitsrichtlinien zur Entlüftung beachtet werden.
Es wird als Isoliergas für Routinetests (Prüfung) mikroelektronischer Schaltkreise im Rahmen der Qualitätssicherung verwendet.
Bei der Herstellung von Halbleiter-Bauteilen dient es als Ätzgas: SF6 ist das reaktive Gas beim reaktiven Ionenätzen (RIE) und DRIE (von engl. Deep Reactive Ion Etching). Außerdem wird es auf ähnliche Weise zum Reinigungsätzen unter anderem in der Display-Fertigung eingesetzt.
Weiterhin verwendet man SF6 als Schutzgas bei der Gewinnung von Magnesium. Das SF6, spezifisch schwerer als Luft, verhindert hier den Kontakt der heißen Metallschmelze mit der Umgebungsluft. Prozessbedingt werden bei dieser Anwendung sehr große SF6-Mengen in die Atmosphäre abgegeben.
SF6 wurde früher als Isoliergas zwischen Isolierglasscheiben benutzt sowie als Füllgas in Sohlen von Sportschuhen. Außerdem wurde Schwefelhexafluorid bis etwa zum Jahr 2000 auch zur Befüllung von Autoreifen eingesetzt, obwohl das pro Reifensatz bis zu 100 DM (ca. 50 Euro) kostete. Alle drei vorgenannten Anwendungen sind inzwischen aus Gründen des Umweltschutzes verboten.
Aufgrund seiner physikalischen Eigenschaften, der geringen Hintergrundkonzentration in der Atmosphäre und der sehr guten Nachweisbarkeit in Gasanalysatoren wird SF6 aktuell noch als Tracergas für Lüftungseffizienz-Messungen in sehr geringen Mengen verwendet. Für viele Anwendungen werden jedoch mittlerweile weniger klimaschädliche Gase eingesetzt.
In der Augenheilkunde wird ein Gemisch aus Schwefelhexafluorid und Luft gegen Netzhautablösung eingesetzt, um ein Wiederanlegen der Netzhaut zu erreichen. Dazu wird während der operativen Glaskörperentfernung (Vitrektomie) das Gasgemisch in den Glaskörperraum (Camera vitrea bulbi) zu dem Zweck eingebracht, die Netzhaut auf ihre Unterlage zu drücken (Endotamponade).
SF6 wird als Ultraschallkontrastmittel in der Medizin seit dem Jahre 2001 eingesetzt. Hier dient es insbesondere dem Nachweis Lebermetastasen maligner Tumore. Vorteile sind eine sehr hohe zeitliche und örtliche Kontrastauflösung. Schilddrüsenerkrankungen und Niereninsuffizienz stellen keine Kontraindikation zur Durchführung dieser Untersuchung dar. Mit Hilfe von SF6 können Leberherde zu ca. 90 % korrekt nachgewiesen werden.
Klimarelevanz
SF6-Gas ist laut Viertem Sachstandsbericht des IPCC (Intergovernmental Panel on Climate Change, Zwischenstaatlicher Ausschuss für Klimaänderungen) das stärkste bekannte Treibhausgas. 1 kg dieses Gases ist, auf einen Zeitraum von 100 Jahren betrachtet, genauso wirksam wie 22.800 kg Kohlenstoffdioxid (CO2).
Wegen der sehr geringen Konzentration von SF6 in der Erdatmosphäre (ca. 5 ppt (Parts per trillion) volumenbezogen, was 0,12 ppmV CO2-Äquivalent entspricht.; CO2 ca. 400 ppm) wird sein Einfluss auf die globale Erwärmung jedoch noch als verhältnismäßig gering betrachtet. Es trägt nicht wesentlich zur Zerstörung der Ozonschicht bei.
Der Abbau von SF6 in der Atmosphäre durch energiereiche UV-Strahlung der Sonne dauert ca. 3.200 Jahre. Die Emission durch elektrotechnische Anlagen in Deutschland betrug 1997 10 % von 238 t der Gesamtemission. Der relative Anteil der Elektrischen Industrie am Ausstoß schwankt stark zwischen verschiedenen Ländern und variiert, nach von der Industrie gemeldeten Daten, im Zeitraum 1990–2012 zwischen 20–30 % (EU) und 70–80 % (US).
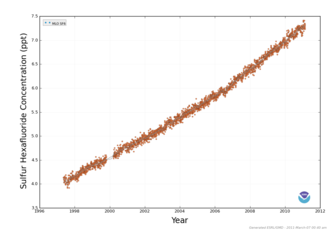
Der Anstieg der SF6-Konzentration in den letzten Jahren beträgt an der Station Bukit Kototabang in Indonesien von 5,3 ppt Anfang 2004 auf 6,3 ppt Ende 2008, was einem Anstieg um ca. 19 % in fünf Jahren entspricht.
Im Jahr 2016 wurden in Deutschland 1142 Tonnen Schwefelhexafluorid an Verwender abgegeben, das sind ungefähr 2 % oder 23 Tonnen mehr als 2015. Die Klimawirksamkeit der Menge im Jahre 2016 beträgt 26 Millionen Tonnen CO2-Äquivalente, wobei Teile dieser Menge auch in geschlossene Systeme gefüllt wurden. Für diese Berechnung wurde der Treibhauseffekt-Faktor 22.800 gegenüber CO2 für einen Zeithorizont von 100 Jahren genutzt. Die Hauptmenge gelangte in den Wirtschaftsbereich Elektroindustrie und Apparatebau mit 21,9 Millionen Tonnen CO2-Äquivalenten für 2016, gefolgt von der Halbleiterindustrie mit 1,2 Millionen Tonnen CO2-Äquivalenten.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.03. 2025
