
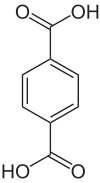
Terephthalsäure
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK |
5 mg/m3 (gemessen als einatembarer Aerosolanteil) | ||||||
| Toxikologische Daten | > 6400 mg/kg (LD50, Ratte, oral) | ||||||
Terephthalsäure oder para-Phthalsäure ist eine organisch-chemische Verbindung und gehört zu den aromatischen Dicarbonsäuren (Benzoldicarbonsäuren). Der Name der Säure leitet sich von Terpentinöl, durch dessen Oxidation sie erstmals dargestellt wurde, sowie von Phthalsäure, zu der sie isomer ist, ab. Üblicherweise wird sie in Form eines farblosen, rieselfähigen Pulvers zur Herstellung von gesättigten Polyestern verwendet. Konstitutionsisomere sind die Phthalsäure und die Isophthalsäure. Wegen der rasant wachsenden Produktionsmengen des Polyesters Polyethylenterephthalat (PET) wird der Verbrauch des Hauptmonomeren Terephthalsäure im Jahr 2012 auf ca. 50 Millionen Tonnen geschätzt. Damit zählt Terephthalsäure zu den volumenmäßig größten organischen Chemieprodukten weltweit.
Gewinnung und Darstellung
Synthese aus fossilen Rohstoffen
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Terephthalsäure |
| Andere Namen |
|
| Summenformel | C8H6O4 |
| Kurzbeschreibung | farbloser, kristalliner Feststoff mit säuerlichem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 100-21-0 |
| EG-Nummer | 202-830-0 |
| ECHA-InfoCard | 100.002.573 |
| PubChem | 7489 |
| Eigenschaften | |
| Molare Masse | 166,13 g/mol−1 |
| Aggregatzustand | fest |
| Dichte | 1,51 g/cm3 (20 °C) |
| Sublimationspunkt | 402 °C |
| Dampfdruck | 1,33 hPa (78 °C) |
| pKS-Wert |
|
| Löslichkeit | praktisch unlöslich in Wasser: 15 mg/l (20 °C), Alkoholen und Ether, besser löslich in heißer Schwefelsäure, Pyridin, Dimethylsulfoxid und Dimethylformamid |
Terephthalsäure lässt sich aus p-Xylol durch Luftoxidation mit Hilfe von Cobaltnaphthalat als Katalysator herstellen. Dieser Syntheseweg war erstmals 1951 von Ewald Katzschmann entdeckt worden.
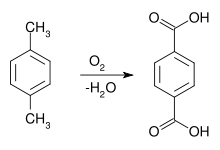
Meist sind diese Katalysatoren heute Kombinationen aus Cobalt, Mangan und Brom oder Cobalt mit einem Co-Oxidant, zum Beispiel Acetaldehyd. Als Reaktions-Lösungsmittel wird 95%ige Essigsäure und eine Katalysatorkombination aus Cobalt- und Mangan-acetat verwendet (Amoco-Verfahren). Die zugesetzte Bromverbindung (NH4Br, Tetrabrommethan, Co- und Mangan(II)-bromid oder HBr) fungiert als Promotor und Radikalüberträger. Die Oxidation mit Luftsauerstoff findet bei modernen Prozessvarianten in Blasensäulen-Reaktoren mit > 150 m³ Fassungsvermögen in der Flüssigphase bei erhöhter Temperatur (> 150 °C, meist 180–210 °C) und Druck (1.500–3.000 kPa) wegen der Korrosivität des Reaktionsgemischs in Titan- oder Hastelloy C-Reaktoren statt. Die Abführung der Reaktionsenthalpie erfolgt durch Siedekühlung der verdampfenden Essigsäure. Die Reaktion verläuft mit ca. 96%iger Ausbeute an Terephthalsäure und führt über intermediär gebildete Hydroperoxide zunächst zu p-Tolualdehyd und zur p-Toluylsäure. Deren Methylgruppe ist durch den elektronenziehenden Einfluss der paraständigen Carboxygruppe stark deaktiviert, so dass sich die weitere Oxidation wesentlich aufwendiger gestaltet. Eine weitere Komplikation ist die Bildung von 4-Carboxybenzaldehyd (4-CBA bzw. 4-Formylbenzoesäure), die das Endprodukt gelblich verfärbt. 4-CBA wird nach Ausschleusen des als Suspension anfallenden Reaktionsgemischs aus dem Reaktor, der Entfernung der wasserhaltigen Essigsäure und Lösen der rohen Terephthalsäure in Wasser bei ca. 250 °C unter Druck durch katalytische Hydrierung in p-Toluylsäure umgewandelt und der Oxidationsreaktion wieder zugeführt.
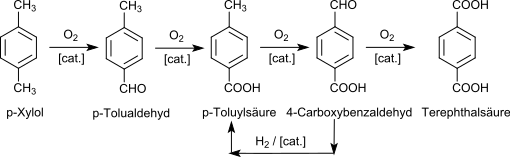
Die erhaltene „faserreine“ Terephthalsäure (englisch purified terephthalic acid, PTA) enthält < 25 ppm 4-CBA und weist eine Reinheit von > 99,99 % auf, wie sie für die Erzielung hoher Molmassen bei der Polykondensation mit Diolen zu Polyestern erforderlich ist. Mit einem Gasgemisch von Sauerstoff und Kohlendioxid verläuft die Oxidationsreaktion deutlich schneller (+26 %) und selektiver, da die Bildung von 4-CBA zurückgedrängt wird, was zu erheblichen Kosteneinsparungen führen sollte.
Mit Erlangung der technischen Reife des Luftoxidationsverfahrens zur hochreinen Terephthalsäure wurden andere Oxidationsprozesse mit Salpetersäure oder Verfahrensvarianten, die zu Dimethylterephthalat (DMT) führen, obsolet.
Ebenfalls veraltet ist die Isomerisierung von Dikaliumphthalat zu Dikaliumterephthalat (sog. Henkel-I-Verfahren), sowie die Disproportionierung von Kaliumbenzoat zu Dikaliumterephthalat und Benzol (Henkel-II-Verfahren), da die vollständige Rückführung des Kaliums nicht ökonomisch gelöst werden konnte. Auch Verfahren, die über eine Ammonoxidation von p-Xylol zu Terephthalonitril und nachfolgende Hydrolyse verlaufen, haben sich wegen der aufwendig zu entfernenden stickstoffhaltigen Verunreinigungen in der Praxis nicht bewährt.
Nach modernen Varianten des Amoco-Verfahrens werden derzeit Anlagen zur Herstellung von PTA mit Jahreskapazitäten über 1 Mio. Tonnen/Jahr und Einzelreaktoren mit Jahreskapazitäten von über 100,000 Tonnen/Jahr gebaut. Das Verfahren eignet sich auch zur Direktoxidation anderer methylierter Benzole oder Naphthaline zu den entsprechenden aromatischen Carbonsäuren, wie z.B. 2,6-Naphthalindicarbonsäure aus 2,6-Dimethylnaphthalin.
Weitere Verfahren beruhen auf der Carboxylierung von Benzoesäure mit Kaliumhydrogencarbonat (Kolbe-Schmitt-Reaktion) sowie auf der Isomerisierung von Kaliumphthalat.
Synthese aus nachwachsenden Rohstoffen
Die Initiative großer Softdrink-Hersteller zur Einführung von Getränkeflaschen aus „Bio-PET“, das aus vollständig von erneuerbaren Rohstoffen abgeleiteten Monomeren hergestellt werden soll, rückt Alternativrouten zu Terephthalsäure, ausgehend von (potentiell) großvolumigen Biomolekülen, in den Fokus umfangreicher Forschungsaktivitäten.
Als aussichtsreich werden die folgenden Syntheserouten gehalten, bei denen der C8-Aromat p-Xylol durch Verknüpfung biogener C2n-Reaktanden (z.B. C6 plus C2 in Prozess 1.) bzw. durch oxidative Entfernung überzähliger Substituenten (C10 minus C2 in Prozess 3.) und nachfolgende Aromatisierung erzeugt wird:
1. Diels-Alder-Reaktion (Addition) von Ethylen an 2,5-Dimethylfuran zu p-Xylol in einer C6 + C2-Verknüpfung (Verfahren der UOP LLC):
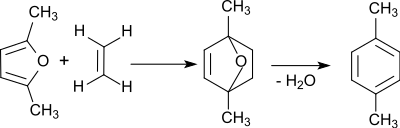
2,5-Dimethylfuran ist aus Hexosen wie Glucose oder Fructose über Hydroxymethylfurfural sowie neuerdings auch direkt aus Cellulose in guten Ausbeuten zugänglich. Mit Ethylen aus Bioethanol stammen hier alle Ausgangsmaterialien aus nachwachsenden Quellen.
2. Dehydratisierung von Isobutanol zu Isobuten, Dimerisierung zum Isoocten und Cyclisierung zu p-Xylol:
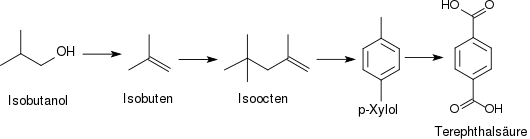
Ausgehend von durch Fermentation von Zuckern oder Cellulose inzwischen in größeren Mengen erhältlichem Isobutanol werden in einer mehrstufigen Reaktionssequenz eine Reihe C8-Verbindungen in einer C4 + C4-Verknüpfung erzeugt, die auch als alternative Treibstoffe von Interesse sind. Dem Nachteil eines längeren Synthesewegs steht der Vorteil der Nutzung großtechnisch realisierter Raffinerieprozesse (Isobuten-Oligomerisierung) entgegen (Verfahren der Gevo Inc. und der Butamax Advanced Biofuels LLC).
3. Dehydrierung und anschließende Oxidation von D-Limonen zu Terephthalsäure:
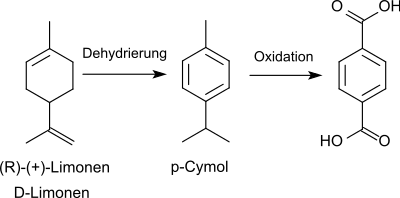
Der Prozess geht von billigem (R)-(+)-Limonen aus Orangenschalen aus, erfordert aber zur Erzielung hoher Ausbeuten Oxidationsmittel wie Eisen(III)-chlorid, Salpetersäure und Kaliumpermanganat, die sich für die Übertragung in einen industriellen Maßstab nicht eignen (Verfahren der SABIC).
4. Zeolith-katalysierte Umwandlung von Biomasse zu BTX-Aromaten. Hierbei wird in einer einstufigen „katalytischen Pyrolyse“ zerkleinerte Biomasse wie Holzabfälle, Pflanzenreste usw. bei ca. 600 °C in einem Wirbelschichtreaktor an einem modifizierten Zeolith-Kontakt mit einer Ausbeute von 40 % zu einem BTX-Gemisch umgesetzt. Das BTX-Gemisch wird auf p-Xylol destillativ aufgearbeitet (Verfahren der Anellotech, Inc.). Auf Grundlage vorläufiger Kostenkalkulationen scheint diese Route mit den Produktionskosten erdölbasierter PTA konkurrieren zu können.
5. Umwandlung von trans,trans-Muconsäure (2,4-Hexadiendisäure) aus Glucose zu Terephthalsäure:
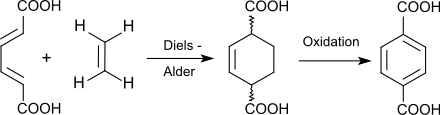
Muconsäure reagiert hier als Dienophil mit Ethylen in einer Diels-Alder-Reaktion in einer C6 + C2-Verknüpfung ohne den Umweg über p-Xylol direkt zur Terephthalsäure-Vorstufe 1,4-Cyclohexendicarbonsäure, die zu Terephthalsäure dehydriert wird (Verfahren der Amyris, Inc.).
6. Umwandlung von löslichen Kohlenhydraten in p-Xylol. Das Verfahren (BioForming®-Prozess) wandelt Pentosen (C5-Zucker) und Hexosen (C6-Zucker) mittels eines sog. Wasserphasen-Reforming (engl. Aqueous Phase Reforming (APR)) genannten Schritts bei erhöhter Temperatur (170–300 °C) und Druck (10–90 bar) Zucker zu einem Gemisch sauerstoffärmerer acyclischer und cyclischer Moleküle um, aus denen durch säurekatalysierte Kondensation BTX-Aromaten gewonnen werden, aus denen wiederum konventionell p-Xylol abgetrennt und dieses weiter in PTA umgesetzt wird (Verfahren der Virent Energy Systems, Inc.). Auf den ersten Blick scheinen Verfahren nach dem Prinzip „Biomasse zu Biomonomeren“ am aussichtsreichsten (s. Prozess 4.), wobei aber wegen der geringen Energiedichte von Biomasse und damit verbundener hoher Transportkosten wohl nur dezentrale Anlagen mit Kapazitäten bis 250,000 Jahrestonnen realistisch sind. Außerdem erscheint es aus Sicht des Synthesechemikers wenig elegant, sauerstoffreiche Biomoleküle mit einer „Feuer und Schwert-Chemie“ zum Kohlenwasserstoff p-Xylol zu reduzieren, um dieses anschließend aufwendig zu Terephthalsäure zu oxidieren.
Keines der neuen Verfahren ist bisher in die großtechnische Praxis umgesetzt, da hier Parameter wie Rohstoffpreise und -verfügbarkeit, CAPEX (Investitionskosten) und OPEX (Betriebskosten, beeinflusst durch stabile hohe Raum-Zeit-Ausbeuten, Katalysatorstandzeiten, Energiebilanzen usw.) eine entscheidende Rolle spielen. Ob zukünftig Bio-Terephthalsäure-Anlagen mit konventionellen PTA-Anlagen der heutigen Standardkapazität von 1,4 bis 2,2 Millionen Jahrestonnen preislich mithalten können, bleibt abzuwarten.
Eigenschaften
Terephthalsäure kann durch langsame Kristallisation nadelförmige Kristalle ausbilden.
Sie ist in den meisten Lösungsmitteln schwer löslich. Die besten Löslichkeiten (> 10 g in 100 g Lösungsmittel bei Normaltemperatur) erreicht man mit Ammoniaklösung, Natronlauge, Dimethylformamid und Dimethylsulfoxid.
| Löslichkeiten bei 25 °C | |
|---|---|
| Wasser | 0,017 g/100 g |
| Eisessig | 0,013 g/100 g |
| Methanol | 0,1 g/100 g |
| Dimethylformamid | 6,7 g/100 g |
| Dimethylsulfoxid | 19,0 g/100 g |
Wegen der geringen Löslichkeit der Terephthalsäure in Wasser und Alkoholen wurde die in früheren Oxidationsverfahren aus p-Xylol anfallende technische Säure über den Diester Dimethylterephthalat (DMT) durch Vakuumdestillation und Umkristallisation aus Methanol oder Xylol zu faserreinem DMT gereinigt und anschließend wieder zur Terephthalsäure hydrolysiert.
Verwendung
Sie wird hauptsächlich zur Herstellung von gesättigten Polyestern mit aliphatischen Diolen als Comonomer verwendet. Etwa 90 Prozent der Jahresproduktion von Terephthalsäure gehen in die Produktion des Kunststoffs Polyethylenterephthalat (PET) (ca. 2/3 der Gesamtmenge) und Lebensmittelverpackungen (ca. 1/3), insbesondere Getränkeflaschen. Als Comonomere werden dabei Ethylenglycol und bis zu 5 mol% Isophthalsäure und Diethylenglycol verwendet. Die jährliche Produktionsmenge von Terephthalsäure im Jahr 2006 betrug 37,3 Millionen Tonnen, bis 2014 soll die PTA-Kapazität um mehr als 15 Millionen Tonnen zunehmen, davon ca. 68 % in China. Einige hunderttausend Tonnen Terephthalsäure fließen in die Produktion technischer Polyester wie Polybutylenterephthalat (PBT) für thermisch anspruchsvollere Automobilanwendungen im Motorraum und relativ geringe Mengen in aromatische Polyamide vom Typ Aramid (z.B. Kevlar™) für hochreißfeste Fasern.
Terephthalsäure wird außerdem als Linkermolekül für die Synthese von Metall-organischen Gerüstverbindungen eingesetzt. Dazu gehören beispielsweise die Strukturfamilien MOF-5, MIL-53, MIL-68, MIL-88 oder MIL-101.
Sicherheitshinweise
Terephthalsäure ist nicht sehr toxisch. Bei Kontakt kann es zu leichten, reversiblen Reizungen der Haut, der Augen und Atemwege kommen. Die orale LD50 liegt für Ratten bei 18,8 g/kg Körpergewicht, für Mäuse bei 6,4 g/kg. Bei der Aufnahme von hohen Dosen (etwa 3 Prozent), die dem Futter beigemischt wurden, kam es bei Ratten zur Bildung von Blasensteinen aus Calciumterephthalat. Diese Steine verletzten die Harnblase und führten zu Krebs.
Terephthalsäurestäube können mit der Luft explosionsfähige Gemische bilden. Die für eine Explosion nötige Minimalkonzentration von Terephthalsäure ist 40 g/m3 bei 20 °C, der erforderliche Sauerstoffanteil liegt bei 12,4 Prozent. Bei 150 °C ist nur noch ein Sauerstoffanteil von 11,1 Prozent nötig. Es wurde errechnet, dass über einer Konzentration von 1400 g/m3 Terephthalsäure keine Explosion mehr erfolgt.
Der Flammpunkt von Terephthalsäure beträgt 260 °C und die Zündtemperatur liegt bei 678 °C. Bei der Reaktion mit starken Oxidationsmitteln kann es zu Hitzeentwicklung kommen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.02. 2025