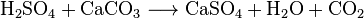Calciumsulfat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | 1,5 mg/m3 | ||||||
Calciumsulfat ist eine chemische Verbindung aus der Gruppe der Calciumverbindungen und Sulfate, dessen Dihydrat als Gips bekannt ist.
Vorkommen
Calciumsulfat kommt natürlich in Form der Minerale Anhydrit CaSO4, Gips Ca[SO4]·2H2O (Dihydrat) und Bassanit Ca[SO4]·½H2O (Hemihydrat) in Evaporiten vor.
| Strukturformel | |
|---|---|
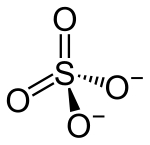 | |
| Allgemeines | |
| Name | Calciumsulfat |
| Andere Namen |
|
| Summenformel | CaSO4 |
| CAS-Nummer |
|
| PubChem | 24928 |
| Kurzbeschreibung | weißer geruchloser Feststoff |
| Eigenschaften | |
| Molare Masse | 136,11 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,96 g/cm3 |
| Schmelzpunkt | Der Stoff zersetzt sich beim Erhitzen (Zersetzungstemperatur bei 700 °C) |
| Löslichkeit | Schwer löslich in Wasser (ca. 2 g/l1 bei 20 °C) |
Gewinnung und Darstellung
Es fällt als Dihydrat bei vielen Abwasserreinigungsverfahren, wenn es um die Neutralisation von sulfathaltigen Prozessabwässern oder schwefelsauren Beizen geht, und in großen Mengen auch bei der Rauchgasentschwefelung zusammen mit Calciumsulfit an.
Weil Calciumsulfat bei vielen chemischen Prozessen (in der Regel in Form von Gips) als Sekundärprodukt entsteht, beispielsweise bei der Citronensäureherstellung, erübrigt sich eine gezielte industrielle Herstellung im größeren Stil. Der bei der Herstellung von Phosphorsäure entstehende sogenannte Phosphorgips ist u.a. mit Uran verunreinigt und ein Problemabfall. Der klassische Prozess ist die Fällung aus schwefelsaurem Wasser mit Kalkmilch oder Kalkstein:
Calciumsulfat-Modifikationen
- α-Halbhydrat (CaSO4 • ½ H2O) entsteht in einem geschlossenen Gefäß (Autoklav) unter Nassdampfatmosphäre beziehungsweise drucklos in Säuren und wässrigen Salzlösungen. Er ist Ausgangsstoff für härtere Gipse (Typ III, IV und V) und benötigt weniger Wasser, aber mehr Zeit zum Abbinden.
- β-Halbhydrat (CaSO4 • ½ H2O) entsteht beim Brennen in einem offenen Gefäß unter normaler Atmosphäre. Beim Vermischen mit Wasser erfolgt innerhalb von Minuten eine Hydratation zum Dihydrat. Er ist Ausgangsstoff für die weicheren Gipse.
Im Fall von α- und β-Halbhydrat handelt es sich nicht um unterschiedliche Modifikationen, sondern um unterschiedliche Kristallinitätszustände der Halbhydratstruktur.
- Anhydrit III (CaSO4 • x H2O; 0< x< 0,5) entsteht bei Temperaturen bis 300 °C aus dem Halbhydrat. Bei Vorhandensein von Wasser, auch Luftfeuchtigkeit, bildet sich sehr schnell Halbhydrat.
- Anhydrit IIs (CaSO4) entsteht bei Temperaturen zwischen etwa 300 bis 500 °C, das s steht für „schwerlöslich“. Beim Vermischen mit Wasser erfolgt die Hydratation innerhalb von Stunden und Tagen.
- Anhydrit IIu (CaSO4) bildet sich bei Temperaturen von 500 bis 700 °C aus dem Anhydrit IIs, das u steht dabei für „unlöslich“.
- Anhydrit I (CaSO4) ist die Hochtemperaturmodifikation des CaSO4, sie bildet sich bei 1180 °C.
Eigenschaften
Calciumsulfat ist ein weißer geruchloser Feststoff, der schwer löslich in Wasser ist und sich ab einer Temperatur von 800 °C zersetzt, wobei Calciumoxid und Schwefeltrioxid entstehen. Die Kristallwasserabspaltung des Dihydrats erfolgt bei 100-130 °C, die des Halbhydrats bei Temperaturen größer als 120 °C. Calciumsulfat ist in mineralhaltigem Quell-, Trink- und Leitungswasser gelöst und bildet zusammen mit Calciumchlorid und den entsprechenden Salzen des Magnesiums die permanente (bleibende) Wasserhärte. Es kristallisiert aus wässriger Lösung bei Raumtemperatur als Dihydrat (Gips) aus. Dieses kristallisiert monoklin in der Raumgruppe A2/a mit den Gitterparametern a = 6,52 Å; b = 15,18 ;Å; c = 6,29 Å und β = 127,4° sowie 4 Formeleinheiten pro Elementarzelle. Das Halbhydrat Bassanit kristallisiert monoklin in der Raumgruppe I2 mit den Gitterparametern a = 12,04; b = 6,93; c = 12,67 und β = 90,27° sowie 12 Formeleinheiten pro Elementarzelle.
Verwendung
Das Hauptanwendungsgebiet der CaSO4-Phasen liegt im Baustoffsektor. In der Lebensmittelindustrie entsteht es als Nebenprodukt bei der Herstellung von Weinsäure und ist als Festigungsmittel, Säureregulator und Trägerstoff zugelassen. Unter anderem wird es bei der Herstellung von Tofu eingesetzt.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 08.03. 2022