
Tellurige Säure
| Sicherheitshinweise | |||
|---|---|---|---|
|
Tellurige Säure ist eine anorganische chemische Verbindung des Tellurs.
Gewinnung und Darstellung
| Strukturformel | ||
|---|---|---|
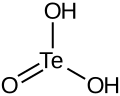
| ||
| Allgemeines | ||
| Name | Tellurige Säure | |
| Andere Namen | Dihydrogentrioxotellurat | |
| Summenformel | H2TeO3 | |
| Kurzbeschreibung | weißer Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 233-173-8 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 177,61 g/mol | |
| Aggregatzustand | fest[1] | |
| Dichte | 3,05 g/cm3[2] | |
| Löslichkeit | sehr wenig löslich in Wasser[1] | |
Tellurige Säure kann durch Reaktion einer Kaliumtellurit-Lösung mit verdünnter Salpetersäure gewonnen werden.[1]
Ebenfalls möglich ist die Darstellung durch Reaktion von Tellurdichlorid oder Tellurtetrachlorid mit Wasser.[4]
Eigenschaften
Tellurige Säure ist ein weißer, amorpher Feststoff von etwas wechselnder Zusammensetzung, deren Wassergehalt häufig unterhalb der Formel H2TeO3 liegt. Sie verliert in trockenem Zustand Wasser, kann aber unter Wasser mehrere Tage unverändert aufbewahrt werden. Beim Erwärmen findet oberhalb Zimmertemperatur weitgehende Wasserabspaltung und Umwandlung zu Tellurdioxid statt.[1] Die Verbindung ist schwach amphoter und reagiert mit Basen (zu Telluriten) und starken Säuren.[5]
Einzelnachweise
- ↑ Hochspringen nach: a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 437.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011,
ISBN 1-4398-1462-7, S. 415
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012,
ISBN 0-444-59553-8, S. 185
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 634.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.01. 2026