Salzbildungsreaktion
Salzbildungsreaktionen sind verschiedene chemische Reaktionen, bei denen als Produkt ein Salz entsteht. Um ein bestimmtes Salz herzustellen, muss man Reaktionspartner suchen, die die zwei Bestandteile eines Salzes liefern. Dazu gehört ein Kation (Metall, Ammonium-Ion) und ein Anion einer Säure.
Komplizierter ist die Herstellung eines Salzes, wenn mehrere verschiedene Anionen und Kationen in einem Salz enthalten sind.
Neutralisation von Säure und Base
Bei der Neutralisation reagiert eine Base mit einer Säure zu einem Salz und Wasser. Die Bestandteile in der Säure (Oxonium-Ionen) und der Base (Hydroxid-Ionen), die ihre sauren bzw. alkalischen Eigenschaften ausmachen, reagieren miteinander zu Wasser.
Achtung: Stark konzentrierte Lösungen können sich bei der Neutralisation so stark erwärmen, dass es zum Verspritzen der Lösung kommen kann.
- Allgemeine Reaktionsgleichung
- Beispiel 1
- Salzsäure + Natronlauge → Natriumchlorid + Wasser
- Beispiel 2
- Schwefelsäure + Bariumhydroxid → Bariumsulfat + Wasser
Synthese aus den Elementen
Ein binäres Salz (besteht aus einem Metall-Ion und aus einem Nichtmetall-Ion) kann durch eine direkte Reaktion der beiden Elemente hergestellt werden. Dabei findet eine Redoxreaktion mit Übertragung von Elektronen vom Metall zum Nichtmetall statt. Die Reaktion kann gegebenenfalls sehr heftig sein.
- Allgemeine Reaktionsgleichung
- Beispiel 1
- Natrium + Chlor → Natriumchlorid
Der Ionenübergang vom Natrium zum Chlorid ist eigentlich endotherm, da die gesamte Reaktion jedoch exotherm ist, müssen bei der Salzbildung noch andere Reaktionen eine Rolle spielen: Die Sublimentierungsenergie, Ionisierungsenergie, Bindungsenergie, die Elektronenaffinität sowie die Gitterenergie.
Metall mit Säure
Ist das Metall nicht zu edel, reagiert es mit einer Säure unter Freisetzung von Wasserstoff. Dieser kann entstehen, da Elektronen von Metallatomen auf die Oxonium-Ionen der Säure übertragen werden. Die so entstandenen Anionen bilden mit den Metall-Ionen bei Eindampfen das Salz.
- Allgemeine Reaktionsgleichung
- Beispiel
- Magnesium + Salzsäure → Magnesiumchlorid + Wasserstoff
Index: (aq) zeigt an, dass es sich um in Wasser gelöstes HCl (= Salzsäure) handelt.
Metalloxid mit Säure
Auch viele Metalloxide reagieren mit Säure. Im Gegensatz zur Reaktion von Metallen mit Säuren findet hier keine Redoxreaktion statt. Es handelt sich um eine Umlagerung. Dabei entstehen aus dem Sauerstoff des Oxides und Oxonium-Ionen mehrere Wassermoleküle.
- Allgemeine Reaktionsgleichung
- Beispiel 1
- Natriumoxid + Salzsäure → Natriumchlorid + Wasser
- Beispiel 2
- Kupfer(II)-oxid + Schwefelsäure → Kupfersulfat + Wasser
/DD>
Nichtmetalloxid mit Lauge
Entsprechend der obigen Reaktion verbinden sich Oxide von Nichtmetallen mit Laugen zu Salzen:
- Allgemeine Reaktionsgleichung
- Beispiel
- Kohlenstoffdioxid + Calciumhydroxid → Calciumcarbonat + Wasser
Anmerkung: Im Grunde entsprechen die Möglichkeiten aus Nichtmetalloxid und Lauge bzw. Metalloxid mit Säure der aus Säure und Lauge, da Nichtmetalloxide mit Wasser Säuren bilden und Metalloxide mit Wasser Laugen entstehen lassen.
Salz mit Säure
Entsprechend dem Prinzip ... Die stärkere Säure vertreibt die schwächere aus ihrem Salz1 oder Die schwerflüchtige Säure vertreibt die leichtflüchtige aus ihren Salzen2 ... kann man auch aus einem Salz und einer Säure ein anderes Salz herstellen.
- Allgemeine Reaktionsgleichung
- Salz + stärkere Säure → Salz der stärkeren Säure + schwächere Säure1 oder
- Salz + schwerflüchtige Säure → Salz der schwerflüchtigen Säure + leichtflüchtige Säure2
- Beispiel zu 1
- Natriumcarbonat + Salzsäure → Natriumchlorid + Kohlensäure
- Beispiele zu 2
- Kaliumbromid + Phosphorsäure → Kaliumdihydrogenphosphat + Bromwasserstoff
- Diese Reaktion findet nur bei erhöhter Temperatur statt, bei der der Bromwasserstoff aus der Mischung entweicht. Bei noch höheren Temperaturen kann auch das Dihydrogenphosphation in gleichem Sinn reagieren.
- Natriumchlorid + Schwefelsäure → Natriumsulfat + Chlorwasserstoff
- Diese Reaktion ist ein Beispiel bei dem sich nach dem Prinzip von Le Chatelier die vom pKS-Wert her stärkere Säure wegen ihrer größeren Flüchtigkeit aus ihrem Salz verdrängt wird. Es ist eine der ältesten Synthesemöglichkeiten von Chlorwasserstoff (Methode von Kipp).
Salz mit Salz
In wässriger Lösung können zwei Salze Ionen „austauschen“. Es entstehen somit zwei neue Salze. Jedoch funktioniert dies nur unter der Bedingung, dass eines der beiden entstehenden Salze in Wasser schwer löslich ist. Es bildet einen Niederschlag. Eine andere Möglichkeit ist die Bildung eines Doppelsalzes bei der Mischung von zwei Einzelsalzlösungen. Diese Doppelsalze sind häufig schwerer löslich und kristallisieren bereits nach der Mischung aus.
- Allgemeine Reaktionsgleichung
- Salzlösung A + Salzlösung B → Salz(lösung) C + Salzlösung D
- oder
- Salzlösung A + Salzlösung B → Salz(lösung) C
- Beispiel
- Natriumchlorid + Silbernitrat → Silberchlorid + Natriumnitrat
- Beispiel Doppelsalz
- Aluminiumsulfat + Kaliumsulfat → Kalium-Aluminium-Alaun
Verwendungszwecke: Durch Farbe bzw. Löslichkeit des Niederschlags in bestimmten Stoffen lassen sich anhand solcher Reaktionen Anionen oder auch Kationen identifizieren (quantitative Analyse). Unter Alaune werden Anwendungen für diese Doppelsalze angegeben.
Bildung organischer Salze
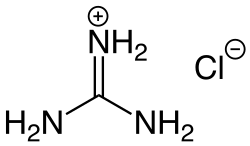
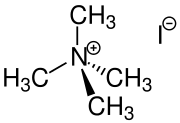
Es gibt auch eine Vielzahl von Salzbildungsreaktionen in der organischen Chemie:
- Hydrohalogenide (Hydrofluoride, Hydrochloride, Hydrobromide oder Hydroiodide) bilden sich durch die Umsetzung von Halogenwasserstoffen (Fluorwasserstoff, Chlorwasserstoff, Bromwasserstoff oder Iodwasserstoff) mit organischen Aminen oder Aminosäuren.
- Alkoholate bilden sich durch die Umsetzung von Alkoholen mit Alkali- oder Erdalkalimetallen.
- Thioalkoholate (Thiolate) bilden sich durch die Umsetzung von Thiolen mit Alkali- oder Erdalkalimetallen.
- Enolate bilden sich unter basischen Bedingungen aus Enolen.
- Phenolate bilden sich durch Umsetzung mit Alkalimetallen oder -hydroxiden aus Phenolen.
- Oxoniumsalze bilden sich aus Alkoholen oder Ethern durch Umsetzung mit Säuren.
- Pyridiniumsalze entstehen bei der Reaktion von Pyridin mit Säuren.
- Tetraalkylammoniumsalze entstehen durch die Umsetzung von Trialkylaminen mit reaktiven Halogenalkanen, wie z. B. Methyliodid.
- Seifen bilden sich bei der Verseifung von Fetten oder Ölen mit Alkali- oder Erdalkalimetallhydroxiden.
- Alkylbenolsulfonate (anionenaktive Tenside) bilden sich bei der Reaktion der Alkylbenolsulfonsäuren mit Alkalimetallhydroxiden.
- Triphenylchlormethan kann als Salz aus dem Triphenylmethyl-Kation und Chlorid als Anion (siehe auch Triphenylmethanfarbstoffe) auftreten.
- N-Acylimminiumchloride bilden sich durch die chemische Reaktion von Iminen mit Acylchloriden (= Carbonsäurechloride).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 29.07. 2025