Essigsäureethylester
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK |
| ||||||||
| Toxikologische Daten | 5620 mg/kg (LD50, Ratte, oral) | ||||||||
Essigsäureethylester, auch Ethylacetat oder Essigester, ist eine chemische Verbindung aus der Gruppe der Carbonsäureester. Es ist der Ester von Essigsäure und Ethanol. Die farblose Flüssigkeit ist ein charakteristisch fruchtig riechendes Lösungsmittel, das in der chemischen Industrie und in Laboratorien oft verwendet wird.
| Strukturformel | ||
|---|---|---|
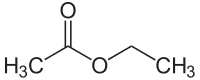 | ||
| Allgemeines | ||
| Name | Essigsäureethylester | |
| Andere Namen |
| |
| Summenformel | C4H8O2 | |
| CAS-Nummer | ||
| EG-Nummer | 205-500-4 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Kurzbeschreibung | farblose Flüssigkeit mit fruchtigem Geruch | |
| Eigenschaften | ||
| Molare Masse | 88,11 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 0,894 g/cm3 (25 °C) | |
| Schmelzpunkt | −83 °C | |
| Siedepunkt | 77°C | |
| Dampfdruck | 98,4 hPa (20 °C) | |
| Löslichkeit | mäßig in Wasser (85,3 g/l bei 20 °C) | |
| Brechungsindex | 1,372 | |
Er entsteht auch bei Fermentationsprozessen, z. B. von alkoholischen Getränken. Technisch wird er als Duft- und Aromastoff eingesetzt. Besonders große Mengen werden als Lösungsmittel in Industrie und Forschung verwendet sowie in verschiedenen Produkten wie Farben, Beschichtungen, Klebstoffen, Kosmetika und Drucktinte. Die Produktionsmenge beträgt mehrere Millionen Tonnen pro Jahr, es handelt sich also um eine industriell wichtige Verbindung.
Vorkommen
Natürlich kommt Essigsäureethylester im Aroma vieler Früchte vor. Flüchtige Aromakomponenten machen nur einen geringen Anteil am Gesamtgewicht der Früchte beziehungsweise Pflanzen aus; in dieser Stoffgruppe ist Essigsäureethylester aber zum Teil eine der mengenmäßig wichtigsten Verbindungen. Die Mengenverhältnisse der flüchtigen Verbindungen in verschiedenen Früchten sind sehr unterschiedlich und hängen auch von der jeweiligen Sorte (also konkreten Genen der Pflanze), dem Reifegrad, der Umgebung der Pflanze und bei geernteten Früchten auch von Transport- und Lagerbedingungen ab.
Herstellung
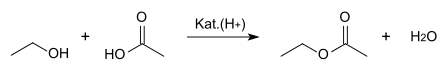
Eines der großtechnischen Herstellungsverfahren der chemischen Industrie beruht auf der säurekatalysierten Veresterung von Ethanol mit Essigsäure:
Diese Gleichgewichtsreaktion wird nach dem Prinzip von Le Chatelier (Massenwirkungsgesetz) durch fortlaufende Abtrennung des entstehenden Wassers oder kontinuierliches Abziehen des Esters auf die Seite der Produkte verlagert.
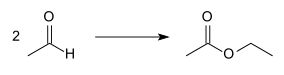
Steht Acetaldehyd ausreichend zur Verfügung, kann Essigsäureethylester mit Aluminiumalkoholat als Katalysator nach Claisen-Tiščenko aus diesem Vorprodukt hergestellt werden:
Eigenschaften
Physikalische Eigenschaften
Ethylacetat liegt unter Normalbedingungen als farblose, niedrigviskose und brennbare Flüssigkeit vor. Der Schmelzpunkt liegt bei −83 °C, wobei eine Schmelzenthalpie von 10,48 kJ/mol realisiert wird. Bei Normaldruck siedet die Verbindung bei 77 °C. Die Verdampfungswärme beträgt am Siedepunkt 31,94 kJ/mol. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,22809, B = 1245,702 und C = −55.189 im Temperaturbereich von 289 K bis 349 K. Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 54,26 kJ/mol, β = 0,2982 und Tc = 523,2 K im Temperaturbereich zwischen 298 K und 363 K beschreiben.
| Eigenschaft | Typ | Wert | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−480,57 kJ/mol −445,43 kJ/mol |
als Flüssigkeit als Gas |
| Standardentropie | S0liquid S0gas |
259,4 J·mol−1·K−1 362,75 J·mol−1·K−1 |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −2235,4 kJ/mol | |
| Wärmekapazität | cp | 168,94 J·mol−1·K−1 (25 °C) 113,64 J·mol−1·K−1 (25 °C) |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 523,2 K | |
| Kritischer Druck | pc | 38,82 bar | |
| Kritische Dichte | ρc | 3,497 mol/l | |
| Azentrischer Faktor | ωc | 0,36641 |
-
 Dampfdruckfunktion von Ethylacetat
Dampfdruckfunktion von Ethylacetat -
 Temperaturabhängigkeit der Verdampfungswärme von Ethylacetat
Temperaturabhängigkeit der Verdampfungswärme von Ethylacetat
In 100 ml Wasser lösen sich ca. 8 ml Essigsäureethylester bei 20 °C. Die Verbindung bildet mit Wasser und vielen organischen Lösungsmitteln azeotrope Gemische. Das Azeotrop mit Wasser enthält bei Normaldruck 8,43 % Wasser und siedet bei 70,38 °C. Die Azeotropzusammensetzung und der Azeotropsiedepunkt ist druckabhängig. Mit sinkendem Druck sinkt der Wassergehalt im azeotropen Gemisch, sowie dessen Siedepunkt.
| p in Torr | 25 | 50 | 75 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 760 | 800 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 | 1500 |
| p in mbar | 33 | 67 | 100 | 133 | 267 | 400 | 533 | 667 | 800 | 933 | 1013 | 1067 | 1200 | 1333 | 1467 | 1600 | 1733 | 1866 | 2000 |
| x(H2O) in % | 3,60 | 4,00 | 4,36 | 4,70 | 5,79 | 6,56 | 7,11 | 7,54 | 7,92 | 8,25 | 8,43 | 8,54 | 8,80 | 9,04 | 9,26 | 9,47 | 9,67 | 9,86 | 10,04 |
| Tb in °C | −1,89 | 10,0 | 17,4 | 23,0 | 37,6 | 46,8 | 53,8 | 59,4 | 64,1 | 68,2 | 70,4 | 71,8 | 75,1 | 78,2 | 81,0 | 83,5 | 85,9 | 88,2 | 90,3 |
wobei 1 Torr ≈ 133,322 Pa entspricht und 760 Torr in etwa der Normaldruck auf Meereshöhe ist.
Die azeotropen Zusammensetzungen und Siedepunkte mit weiteren organischen Lösungsmitteln finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Toluol, Benzol, n-Propanol, n-Butanol, iso-Butanol, sec-Butanol, Aceton, 1,4-Dioxan, Methylacetat und Isopropylacetat gebildet.
| Lösungsmittel | n-Hexan | Cyclohexan | Methanol | Ethanol | 2-Propanol | |
| Gehalt Ethylacetat | in Ma% | 38 | 54 | 56 | 69 | 75 |
| Siedepunkt | in °C | 65 | 72 | 62 | 72 | 76 |
| Lösungsmittel | Chloroform | Tetrachlorkohlenstoff | Butanon | Schwefelkohlenstoff | Acetonitril | |
| Gehalt Ethylacetat | in Ma% | 72 | 43 | 82 | 3 | 77 |
| Siedepunkt | in °C | 78 | 75 | 77 | 46 | 75 |
Sicherheitstechnische Kenngrößen
Ethylacetat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −4 °C. Der Explosionsbereich liegt zwischen 2 Vol.‑% (73 g/m3) als untere Explosionsgrenze (UEG) und 12,8 Vol.‑% (470 g/m3) als obere Explosionsgrenze (OEG). Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −8 °C sowie einen oberen Explosionspunkt von 25 °C. Die Explosionsgrenzen sind druckabhängig. Eine Erniedrigung des Druckes führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog.
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 1,7 | 1,8 | 1,8 | 1,8 | 1,9 | 1,9 | 2,0 | 2,1 | 2,2 | 2,8 | 3,5 |
| in g·m−3 | 62 | 63 | 64 | 65 | 67 | 69 | 71 | 74 | 79 | 102 | 126 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 12,8 | 12,6 | 12,2 | 11,8 | 11,6 | 11,6 | 11,6 | 11,4 | 11,4 | 9,9 | 8,1 |
| in g·m−3 | 468 | 461 | 448 | 433 | 426 | 419 | 419 | 426 | 426 | 364 | 295 |
Die Sauerstoffgrenzkonzentration liegt bei 20 °C bei 9,8 Vol.‑%, bei 100 °C bei 9,4 Vol%. Der maximale Explosionsdruck beträgt 9,5 bar. Der maximale Explosionsdruck verringert sich mit sinkenden Ausgangsdruck.
-
Maximaler Explosionsdruck unter reduziertem Druck Druck in mbar 1013 800 600 300 200 150 100 Maximaler Explosionsdruck (in bar) bei 20 °C 9,2 7,1 5,4 2,6 1,8 1,4 1,1
Die Grenzspaltweite wurde mit 0,95 mm (50 °C) bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Mit einer Mindestzündenergie von 0,46 mJ sind Dampf-Luft-Gemische extrem zündfähig. Die Zündtemperatur beträgt 470 °C. Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit liegt mit < 1·10−7 S/m im mittleren Bereich für flüssige Stoffe.
Entsprechend den Gefahrgutvorschriften ist Ethylacetat der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).
Verwendung

Essigsäureethylester ist ein vielseitig einsetzbares Lösemittel. Essigsäureethylester wird als Extraktionsmittel benutzt, z. B. zur Entkoffeinierung von Kaffeebohnen oder zur Gewinnung von natürlichen Aromastoffen für die Aromatisierung von Limonaden, Bonbons und Arzneimitteln. In Rum und einigen anderen Spirituosen ist es von Natur aus in geringen Mengen vorhanden. Auch im Wein kommt es in geringen Mengen vor, besonders wenn die Trauben durch Hagel oder Fäulnis geschädigt wurden; es verursacht dann einen Lösungsmittelton im Wein.
In Klebstoffen ist es eines der am häufigsten eingesetzten Lösungsmittel. In hoher Konzentration wirkt es als Rauschmittel, welches von sogenannten „Schnüfflern“ verwendet wird, um sich zu berauschen.
Aufgrund seiner starken Lösungskraft findet Essigsäureethylester auch als Bestandteil von Nagellackentfernern Verwendung.
In der Entomologie ist es das am häufigsten eingesetzte Tötungsmittel bei der Präparation von Insekten.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.08. 2025