
Distickstoffmonoxid
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| MAK | |||||||||||
| Treibhauspotential | 298 (bezogen auf 100 Jahre)[9][10] | ||||||||||
Distickstoffmonoxid, allgemein bekannt unter dem Trivialnamen Lachgas, ist eine chemische Verbindung mit der Summenformel N2O. Bei Raumtemperatur ist es ein farbloses, nicht brennbares Gas. Es ist geruchlos und geschmacklos; teilweise wird jedoch über einen leicht süßlichen Geschmack beim Einatmen berichtet. Bei höheren Temperaturen ist Distickstoffmonoxid ein starkes Oxidationsmittel. In der medizinischen Literatur wird Distickstoffmonoxid auch als Stickoxydul oder Stickoxidul bezeichnet.
Distickstoffmonoxid ist ein Spurengas, dessen Konzentration in der Erdatmosphäre seit Beginn des 19. Jahrhunderts stark zugenommen hat. Als Treibhausgas trägt Distickstoffmonoxid zur globalen Erwärmung sowie zum Ozonabbau in der Stratosphäre bei. Ein großer Teil der vom Menschen verursachten Distickstoffmonoxidemissionen sind auf die Landwirtschaft zurückzuführen.
Als Oxidationsmittel wird es in Raketentreibstoffen und im Rennsport zur Leistungssteigerung von Motoren verwendet. Distickstoffmonoxid wird in der Medizin, insbesondere in der Geburtshilfe und Zahnmedizin wegen seiner betäubenden und schmerzlindernden Wirkung eingesetzt. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.
| Strukturformel | ||
|---|---|---|
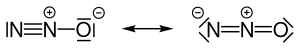
| ||
| Mesomere Grenzstrukturen des Distickstoffmonoxid-Moleküls | ||
| Allgemeines | ||
| Name | Distickstoffmonoxid (INN) | |
| Andere Namen | ||
| Summenformel | N2O | |
| Kurzbeschreibung | farbloses Gas mit süßlichem Geruch[4] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 233-032-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code |
| |
| Wirkstoffklasse | Analgetikum | |
| Eigenschaften | ||
| Molare Masse | 44,01 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte | 1,848 kg/m3 (15 °C, 1 bar)[4] | |
| Schmelzpunkt | −90,8 °C[4] | |
| Siedepunkt | −88,5 °C[4] | |
| Dampfdruck | ||
| Löslichkeit |
| |
| Dipolmoment | 0,16083 D[6] (5,365 · 10−31 C · m) | |
| Brechungsindex | 1,000516 (0 °C, 101,325 kPa)[7] | |
Geschichte
Entdeckung und Nutzung als Narkosegas
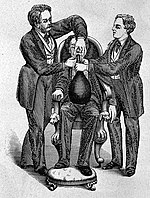
Distickstoffmonoxid wurde erstmals 1771 von dem englischen Pfarrer, Chemiker und Physiker Joseph Priestley rein dargestellt und beschrieben.[11] Die Entdeckung der betäubenden und schmerzstillenden Wirkung geht auf den englischen Apotheker und späteren Chemiker Humphry Davy zurück, der um 1797 begann, die Wirkung von Stickstoffmonoxid durch Selbstversuche zu erforschen. Er setzte es zur Behandlung von Zahnschmerzen ein, veröffentlichte seine Erkenntnisse 1800 und schlug Distickstoffmonoxid auch zur Betäubung bei Operationen vor.[12][13][14] Auch der Begriff „Lachgas“ wurde von Davy geprägt, basierend auf den Reaktionen von Versuchspersonen, denen er das Gas verabreichte.[15] Die deutsche Bezeichnung als „Lachgas“ ist eine Übersetzung des englischen Wortes laughing gas.
Der erste Zahnarzt, der Distickstoffmonoxid als Narkosemittel verwendete, war Horace Wells in Hartford (Connecticut). Er setzte es ab 1844 erfolgreich bei Zahnextraktionen und Dentalbehandlungen ein, nachdem er dessen schmerzstillende Wirkung zufällig bei einer Vergnügungsanwendung am 10. Dezember 1844 beobachtet hatte. Dies war zu seiner Zeit in Europa und vor allem Nordamerika zunächst auf Jahrmärkten und auf „Lachgasparties“ junger Leute üblich.[16] Am folgenden Tag ließ er sich selbst einen Zahn unter Distickstoffmonoxid-Narkose ziehen.
So schrieb Gardner Quincy Colton, der 1863 das nach dem Tod von Horace Wells zunächst als Anästhetikum außer Gebrauch gekommene Distickstoffmonoxid wieder eingeführt hatte, 1866:
“The laughing gas […] acts as an exhilarant, as by supplying an extra supply of oxygen to the lungs, the pulse is increased fifteen to twenty beats to the minute. The former agents carry the patients down towards the point of death: the latter up into increased life.”
„Das Lachgas […] wirkt wie ein Aufputschmittel, denn durch die zusätzliche Zufuhr von Sauerstoff in die Lungen wird der Puls um fünfzehn bis zwanzig Schläge pro Minute erhöht. Die ersteren Mittel führen die Patienten dem Tod entgegen, die letzteren dem Leben entgegen.“
Das am 10. Dezember 1844 in Hartford öffentlich zur Schau gestellte Distickstoffmonoxid wurde als „Exhilarating or Laughing Gas“ bezeichnet und den zu unterhaltenden Zuschauern plakativ angekündigt als Gas, das je nach Charakter der damit berauschten Probanden bei Inhalation Lachen, Singen, Tanzen, Reden oder Prügeln bewirken könne.[18] Da Distickstoffmonoxid zu dieser Zeit noch in hoher Dosierung verabreicht werden musste, um Schmerzfreiheit zu erzielen, kam es nach wenigen Minuten zu lebensbedrohlichen Asphyxien. Daher konnte eine Distickstoffmonoxidnarkose nur bei kurzdauernden Eingriffen angewendet werden.[19] Nach der vom Chicagoer Chirurgieprofessor Edmund Andrews[20] (1824–1904) 1868 publizierten Empfehlung wurde Distickstoffmonoxid zur Erzielung einer wirkungsvollen sowie ausreichend hohen Konzentration in Kombination mit Sauerstoff als Anästhetikum bei klinischen Operationen eingesetzt.[21] Erstmals so praktiziert wurde das ebenfalls von Andrews, der eine Kombination mit mindestens 20 % Sauerstoff empfahl und auch statistische Untersuchungen zur Sicherheit von Äther- und Chloroformnarkosen in jeweils etwa 100.000 Fällen durchführte.[22] Andrews entwickelte auch eine Methode (Kompression) zur Verflüssigung von Distickstoffmonoxid, wodurch die Handhabung erleichtert wurde.[23]
Rolle als Spurengas
Zu Beginn der 1970er Jahre wurde erkannt, dass Distickstoffmonoxid eine bedeutende Rolle als Spurengas in der Erdatmosphäre spielt, das sowohl zum Abbau der Ozonschicht als auch zur Verstärkung des Treibhauseffekts beiträgt. Große Quellen wurde zunächst in den Ozeanen vermutet, während der relativ langsame photochemische Abbau in der Stratosphäre als einzige Senke bekannt war. Um das globale Budget zu erklären, wurde eine große, noch unbekannte troposphärische Senke angenommen. Die atmosphärische Lebensdauer wurde zunächst auf weniger als 20 Jahre geschätzt.[24]
Vorkommen
Terrestrisch
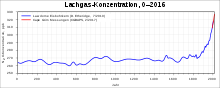
Distickstoffmonoxid wird in der Troposphäre nicht nennenswert abgebaut und in die Stratosphäre transportiert, wo es durch die Reaktion mit atomarem Sauerstoff zu einer Quelle von NOx-Radikalen wird, die in katalytischen Kreisläufen Ozon zerstören.[25] Im Jahr 2018 lag seine Konzentration in der Atmosphäre bei 331 ppb und damit etwa 22 % über dem Wert des vorindustriellen Zeitalters.[25] Die Konzentration von Distickstoffmonoxid im Meerwasser, wo es als Nebenprodukt der aeroben Nitrifikation und als Zwischenprodukt der anaeroben Denitrifikation entsteht, variiert erheblich mit der Jahreszeit und der geographischen Lage. So wurden in der Küstenlagune Al-Shabab an der Ostküste des Roten Meeres Mittelwerte der Distickstoffmonoxidkonzentration von 0,344 Mikromol pro Liter im Frühjahr gemessen, im Winter lagen die Mittelwerte bei 0,106 Mikromol pro Liter.[26] In der Nordwestpassage des Arktischen Ozeans lag die Konzentration zwischen 11,5 und 21 Mikromol pro Liter.[27]
Extraterrestrische Vorkommen
Im Rahmen einer Studie wurden die Rotationsübergänge des Distickstoffmonoxids im interstellaren Raum mit dem 12-m-Teleskop des National Radio Astronomy Observatory radioastronomisch nachgewiesen. Die daraus abgeleitete Dichte im galaktischen Zentrum beträgt etwa ein milliardstel der Wasserstoffdichte.[28] Distickstoffmonoxid spielt möglicherweise eine Rolle als Ausgangsstoff für die in Kometenschweifen nachgewiesenen Stickstoffkationen (N2+), da dessen photochemische Lebensdauer groß genug ist, um in den Kometenschweif zu gelangen. Durch photochemische Reaktionen in Sonnennähe würde Distickstoffmonoxid dort in ein Stickstoffkation und ein Sauerstoffanion zerfallen.[29]
Herstellung
Labormaßstab
Die Herstellung erfolgt in einer intramolekularen Redoxreaktion durch kontrollierte thermische Zersetzung von chloridfreiem Ammoniumnitrat[32]
oder in einer Redoxreaktion durch Erhitzen einer Mischung aus Ammoniumsulfat und Natriumnitrat.
Die Temperatur darf bei beiden Darstellungswegen jedoch nicht höher als 300 °C steigen, da es sonst zu einem explosiven Zerfall von Ammoniumnitrat kommen kann. Um dies zu vermeiden, kann Distickstoffmonoxid durch Reaktion von Harnstoff mit Salpetersäure und Schwefelsäure hergestellt werden. Als Nebenprodukte entstehen dabei Kohlenstoffdioxid, Ammoniumsulfat und Wasser.[33]
Industrielle Prozesse
Als Nebenprodukt fällt Distickstoffmonoxid bei der Herstellung von Salpetersäure, Caprolactam und Adipinsäure in erheblichen Mengen an.[34] Beim SCR-Verfahren, einer Technik zur Reduktion von Stickoxiden in Abgasen von Feuerungs-, Müllverbrennungs- und anderen Industrieanlagen sowie in Gasturbinen und Verbrennungsmotoren, können Stickoxide mit Ammoniak zu Distickstoffmonoxid reagieren, etwa durch die Reaktion:[35]
Drei-Wege-Katalysator
>Bei der Abgasnachbehandlung mittels Drei-Wege-Katalysator erfolgt die Bildung von Distickstoffmonoxid als Teilschritt bei der Reduktion von Stickoxiden zu elementarem Stickstoff. Sie erfolgt bevorzugt unter stöchiometrischen Bedingungen (λ = 1,00) bei Temperaturen von 250 bis 350 °C. Bei normalen Arbeitstemperaturen von etwa 450 °C des Drei-Wege-Katalysators ist die Bildung von Distickstoffmonoxid und allen anderen Schadstoffen jedoch minimal. Die Reaktion zu Distickstoffmonoxid geschieht über die Reaktion von Kohlenstoffmonoxid und Stickstoffmonoxid unter Bildung einer NCO-Spezies an der Katalysatoroberfläche.[36]
Bakterielle Nitrifikation
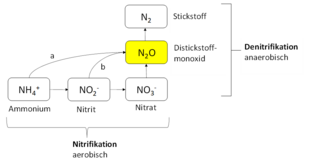
(a) Distickstoffmonoxid-Produktion durch Nitrifikation über Hydroxylamin
(b) Distickstoffmonoxid-Produktion durch Nitrifikanten-Denitrifikation[37]
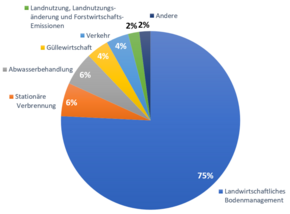
Distickstoffmonoxid wird in erster Linie als Nebenprodukt natürlich ablaufender Prozesse, zum Beispiel im Zuge der bakteriellen Nitrifikation gebildet und in die Atmosphäre freigesetzt.[5][38] Als Nebenprodukt bei von Menschen verursachten Prozessen wird Distickstoffmonoxid nicht nur bei Verbrennungsvorgängen, sondern auch durch intensiv betriebene Landwirtschaft freigesetzt.[39][40] Für den von Menschen verursachten Distickstoffmonoxidausstoß ist vor allem der zunehmende Einsatz von stickstoffhaltigen Düngemitteln in der Landwirtschaft verantwortlich.[41][42] Verglichen mit der konventionell betriebenen Landwirtschaft entstehen bei der ökologischen Landwirtschaft rund 40 % weniger Distickstoffmonoxid pro Hektar.[43]
Die Abwasserbehandlung in Kläranlagen kann zum Beispiel durch ein Ammonium-Oxidationsverfahren zu einer Quelle für Distickstoffmonoxid werden. In der Belüftungsphase kann Distickstoffmonoxid durch Ammonium oxidierende Bakterien über die Oxidation von Hydroxylamin oder durch die Reduktion von Nitrit, die sogenannte Nitrifikanten-Denitrifikation, gebildet werden. In der anaeroben Phase kann Distickstoffmonoxid als Nebenprodukt entstehen. In der Schweiz sind die Kläranlagen für rund 20 % der schweizweiten Distickstoffmonoxid-Emissionen verantwortlich.[44]
| Quellen für Distickstoffmonoxid[5] | globale Emission [106 t/a] |
|---|---|
| natürliche Quellen | 6,6–12,2 |
| • Ozeane/Seen | 2,0–4,0 |
| • natürliche Böden | 4,6–8,2 |
| anthropogene Quellen | 1,4–6,5 |
| • Verbrennung von Biomasse | 0,2–2,4 |
| • Einsatz von künstlichen Düngern (Böden und Grundwasser) | 1,0–3,6 |
| alle Quellen1 | 8,9–18,7 |
Stickstoffdünger wird unter bestimmten Bedingungen in Distickstoffmonoxid umgewandelt. Dabei wird normalerweise N2O im Boden enzymatisch abgebaut. Bei dem ablaufenden biochemischen Prozess spielt das kupferhaltige Enzym Distickstoffmonoxid-Reduktase eine wichtige Rolle, da es N2O zu N2 umsetzt (→ Denitrifikation). Dieses Enzym reagiert auf Sauerstoff empfindlich und fällt in der Reaktionskette häufig aus. Deshalb werden große Mengen an N2O aus gedüngten Ackerflächen freigesetzt.[45] So werden beim Anbau von Energiepflanzen, wie Raps, bedingt durch die verstärkte Düngung, insbesondere im Winter, größere Mengen Distickstoffmonoxid freigesetzt. Die N2O-Emissionen aus dem Rapsanbau entsprechen dabei denen des sonstigen Feldbaues.[46][47] Dadurch ist – bezogen auf die N2O-Emissionen – die Klimabilanz des Raps negativer als die von Benzin.[48]
Diesen Quellen steht als Senke insbesondere der photochemische Abbau in der Stratosphäre mit etwa 20,5·106 t/a gegenüber.[5]
Die Mengen, die zusätzlich durch Aufnahme in Böden und von aquatischen Mikroorganismen abgebaut werden, sind nicht bekannt.
Abiotische Prozesse
Distickstoffmonoxid kann sich unter bestimmten Bedingungen abiotisch an Festkörperoberflächen bilden. Erstmals wurde dies an einem Salzsee in der Antarktis beobachtet.[49] Die Reaktion zu Distickstoffmonoxid ist neben dem Vorkommen von nitrat- oder nitrithaltigen Stoffen auch von der Verfügbarkeit von Eisenmineralien abhängig und läuft nach folgenden Reaktionen ab:
Es besteht die Möglichkeit, dass die abiotische Distickstoffmonoxidproduktion in der Antarktis in ähnlicher Weise auch auf dem Mars und anderen extraterrestrischen Objekten sowie Exoplaneten stattfindet.[50]
Eigenschaften
>Physikalische Eigenschaften
Distickstoffmonoxid ist ein diamagnetisches Gas, das in kaltem Wasser gut löslich: Bei 0 °C löst sich das Gas im Volumenverhältnis 1 : 1,305 in flüssigem Wasser, bei 25 °C immer noch im Verhältnis 1 : 0,596.[51] Es ist dem annähernd gleich schweren, isoelektronischen Kohlenstoffdioxid in seinen physikalischen Eigenschaften wie der Dichte der kondensierten Flüssigkeit oder Schmelz- und Siedepunkt sehr ähnlich. Aus neutralen wässrigen Lösungen lässt sich bei tiefen Temperaturen ein kristallines Gashydrat ausscheiden, in dem auf jedes Distickstoffmonoxid-Molekül 5,75 Wassermoleküle kommen.[52] Unter erhöhtem Druck weist Distickstoffmonoxid eine sehr gute Löslichkeit in Fetten auf. Die Standardbildungsenthalpie ΔfH0g beträgt + 82,10 kJ/mol (metastabil), die Standardenthropie S0g, 1 bar: 219,96 J/(mol · K).
Molekulare Eigenschaften
Das Distickstoffmonoxidmolekül ist linear gebaut und lässt sich wie folgt durch zwei mesomere Resonanzstrukturen darstellen:
![]()
Der Stickstoff-Stickstoff-Bindungsabstand beträgt 112,6 Pikometer und liegt damit zwischen dem einer Stickstoff-Stickstoff-Doppel- und einer Stickstoff-Stickstoff-Dreifachbindung. Die Länge der Stickstoff-Sauerstoff-Bindung beträgt 118,6 Pikometer und liegt damit zwischen dem einer Sauerstoff-Sauerstoff-Einfach- und einer Sauerstoff-Sauerstoff-Doppelbindung.[51]
Chemische Eigenschaften
Distickstoffmonoxid ist nicht brennbar, kann aber andere Stoffe oxidieren. Daher wirkt es brandfördernd. Kohle, Schwefel und Phosphor brennen in Distickstoffmonoxid wie in Sauerstoff, Gemische mit Wasserstoff oder Ammoniak explodieren bei Zündung.[51]
Im Gegensatz zu Sauerstoff reagiert Distickstoffmonoxid mit Stickstoffmonoxid nicht zu braunem Stickstoffdioxid, wodurch sich die beiden Gase unterscheiden lassen.[51] Um andere Stoffe zu oxidieren, benötigt es eine deutlich höhere Temperatur als bei den entsprechenden Reaktionen mit Sauerstoff. Bei der Zündung eines Gasgemisches aus Schwefelkohlenstoff und Distickstoffmonoxid in einer zylindrischen Röhre erzeugt die Reaktion einen hellen Blitz und einem Geräusch, das an einen bellenden Hund erinnert. Als Produkte entstehen elementarer Schwefel, Kohlenstoffdioxid und Stickstoff.[53]
Distickstoffmonoxid ist eine metastabile Verbindung und zerfällt bei etwa 600 °C in seine Elemente:[51]
.
Distickstoffmonoxid kann als Sauerstoff- oder als Stickstoffdonor fungieren, etwa in der Wislicenus-Reaktion, wobei Distickstoffmonoxid mit Natriumamid bei etwa 187 °C zu Natriumazid reagiert.
Die Reaktion wird in der chemischen Industrie zur Herstellung von Aziden verwendet, die als Sprengstoffe eingesetzt werden.[54]
Distickstoffmonoxid oxidiert 9,10-Dihydroanthracen in Gegenwart eines Ruthenium-Katalysators auf zwei verschiedene Arten. In Gegenwart von Schwefelsäure entsteht ein Anthracen-Derivat, in Benzol als Lösungsmittel in Abwesenheit von Schwefelsäure entsteht ein Anthrachinon-Derivat.[55]
Distickstoffmonoxid agiert als Lewis-Base und kann beispielsweise Wasser aus Komplexen verdrängen:[51]
In der oberen Atmosphäre wird Distickstoffmonoxid, dessen Wirkungsquerschnitt stark temperaturabhängig ist, durch Absorption von Sonnenstrahlung mit einer Wellenlänge von etwa 180 bis 240 Nanometern photolysiert, wobei die Quantenausbeute der Photodissoziation gleich eins ist. Bei der Photolyse entstehen molekularer Stickstoff (N2) und angeregter atomarer Sauerstoff (O(1D)).[56]
Umweltrelevanz
Durch die Lage seiner IR-Absorption in einem atmosphärischen Fenster und seine lange atmosphärische Verweilzeit von 109 Jahren hat Distickstoffmonoxid ein hohes Treibhauspotenzial, zumal sein globales Erwärmungspotenzial (bezogen auf 100 Jahre) 273-mal höher ist als das von Kohlenstoffdioxid.[57] Als drittwichtigstes langlebiges Treibhausgas trägt es erheblich zur globalen Erwärmung bei.[58] Sein Beitrag zur globalen Erwärmung über den Treibhauseffekt beträgt knapp 10 %. Seine Emissionen durch -->Denitrifikation von stickstoffhaltigem Dünger machen beispielsweise beim Anbau von Ölsaaten für Biokraftstoffe deren Beitrag zum Klimaschutz vollständig zunichte.[59]
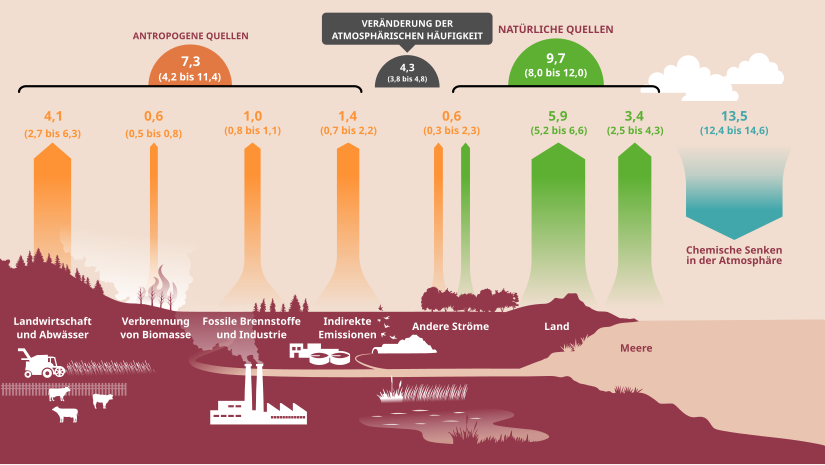
Wissenschaftler veröffentlichten 2020 eine umfassende Quantifizierung der globalen Quellen und Senken des Treibhausgases und berichteten, dass die vom Menschen verursachten Emissionen in den letzten vier Jahrzehnten um 30 % gestiegen sind und die Hauptursache für den Anstieg der atmosphärischen Konzentrationen sind, wobei das jüngste Wachstum die höchsten prognostizierten Emissionsszenarien des IPCC übertrifft.[60][25]
Durch seinen Abbau in der Stratosphäre erhöht Distickstoffmonoxid dort die Konzentration von NOx, das katalytisch Ozon abbaut.[58] Die Oxidation von Distickstoffmonoxid stellt die hauptsächliche Quelle für Stickoxide und Salpetersäure in der Stratosphäre dar. Zu einem kleineren Teil stammen diese aus der Ionisation von molekularem Stickstoff durch energiereiche Teilchen sowie den Emissionen von Flugzeugen.[61] Unter den anthropogenen ozonschädlichen Emissionen ist Distickstoffmonoxid mittlerweile bedeutender als alle Fluorchlorkohlenwasserstoffe (FCKW) zusammen. Im Gegensatz zu den FCKW fällt Distickstoffmonoxid nicht unter die Beschränkungen des Montreal-Protokolls.[62] Der Ozonabbau erfolgt über die Bildung von Stickstoffmonoxid, das in katalytischen Zyklen Ozon abbaut:[63]
Katalytischer Zyklus:
Gesamtreaktion:
Die mittlere troposphärische Distickstoffmonoxidkonzentration stieg zwischen 1980 und 2020 von 301 auf 333 ppb an. Damit erreichte sie den höchsten Wert in den letzten 800.000 Jahren. Im Jahr 2020 betrug die Wachstumsrate 1,33 ppb pro Jahr, im Vergleich dazu lag sie im Jahrzehnt von 2000 bis 2009 noch bei 0,76 ppb pro Jahr.[64]
Verwendung
Narkosemittel

In der Medizin wird Distickstoffmonoxid seit 1844 ein regelmäßig eingesetztes schmerzlinderndes Gas zur Narkose oder in der fixen Kombination von 50 % Distickstoffmonoxid und 50 % Sauerstoff (MEOPA) zur Schmerzbehandlung bei kurzen, mäßig schmerzhaften chirurgischen Eingriffen eingesetzt. Es ist ein relativ schwaches Anästhetikum und wird hauptsächlich unterstützend eingesetzt. In der modernen Anästhesie wird die Wirkung des Distickstoffmonoxids durch Zugabe anderer Narkosemittel ergänzt. Die Weltgesundheitsorganisation führt Distickstoffmonoxid in der Liste der unentbehrlichen Arzneimittel (23. Liste (2023)) im Kapitel 1.1.1: Inhalative Arzneimittel.[65]
Analgetische, schmerzstillende Effekte treten ab einer Konzentration von etwa 20 % Distickstoffmonoxid in der Atemluft auf. Um eine wirkungsvolle Konzentration von 70 % zu erreichen, wird es, wie zuerst Andrews 1868 erkannt hatte, zusammen mit reinem Sauerstoff verabreicht. Vorteilhaft ist, dass das Gas rasch an- und abflutet (geringer Blut/Gas-Verteilungskoeffizient), die Narkose dadurch gut steuerbar ist und keine oder geringe Atemdepression auftritt. Das Gas wird hauptsächlich wieder über die Lungen ausgeschieden, ein geringer Teil diffundiert durch die Haut.[66] Problematisch kann die Diffusion von Distickstoffmonoxid in luftgefüllte Körperhohlräume werden, hierbei kann es zur Diffusionshypoxie in der Lunge kommen. Dabei verdrängt Distickstoffmonoxid den Sauerstoff aus den Lungenbläschen. Dies wird durch Sauerstoffinhalation vermieden.
Der medizinische Gebrauch von Distickstoffmonoxid als Narkosemittel ist seit langem eher rückläufig. Es wurde als geeignet zur Selbstapplikation bei schwachen und mittleren Schmerzen bezeichnet.[67] So wird es heute unter anderem in der Geburtshilfe zur Verringerung der Wehenschmerzen wieder eingesetzt. Ab 1878 hatte bereits der Arzt St. Kjilkowitsch aus Petersburg Distickstoffmonoxid erfolgreich in der Geburtshilfe eingesetzt.[68][69]> Die Wirkung von Distickstoffmonoxid ist nur kurz, bereits nach ungefähr 15 Minuten sind keine Wirkungen mehr wahrnehmbar. Distickstoffmonoxid kann aufgrund der schmerzstillenden Wirkung in der Anästhesie zur Durchführung einer Vollnarkose dem Gasgemisch beigefügt werden, wo es den Verbrauch der inhalativen Anästhetika stark reduziert.
Vor dem Hintergrund alternativer Narkoseverfahren, verbesserter Gerätetechnik wie etwa die low-flow-Anästhesie und erhöhter Vigilanz bezüglich möglicher Umweltbelastungen (Treibhausgas) wird seit Ende der 1990er Jahre weniger Distickstoffmonoxid in der Anästhesie verwendet.[70] Halogenierte Anästhetika, etwa Flurane wie Isofluran, Desfluran und Sevofluran, weisen jedoch ebenfalls ein hohes Ozonabbaupotenzial und ein hohes Treibhauspotenzial auf.[71] Aus medizinischer Sicht ist gegen die Verwendung von Distickstoffmonoxid als Narkosemittel nichts einzuwenden.[72][73] In der Zahnmedizin ist Distickstoffmonoxid seit Jahrzehnten als sogenannte titrierbare Lachgassedierung ein bewährtes Mittel, das vor allem bei Kindern und ängstlichen Patienten oder bei starkem Würgereiz Anwendung findet. Nebenwirkungen sind bei korrekter Verabreichung selten.
Außerdem wird Distickstoffmonoxid bei der Kryoablation als flüssiges Kühlmittel eingesetzt und in den Kryoballonkatheter geleitet. Dort verdampft es und entzieht dem umliegenden Gewebe Wärme. Durch die Eisbildung werden die betroffenen Herzmuskelzellen zerstört.
Verwendung als Droge

Distickstoffmonoxid findet wegen seiner dissoziativen Wirkung und der leichten Verfügbarkeit Verwendung als Rauschmittel.[74] Der Rausch dauert etwa 30 Sekunden bis 3 Minuten an.[75] Es kommt zu dissoziativen Effekten,[74] starker Veränderung der Geräuschwahrnehmung (Echo, Verzerrung),[75] Kribbeln in den Gliedmaßen,[76] Entspannung der Muskeln,[77] traumartigen Halluzinationen[75] und Wohlempfinden, mitunter auch Euphorie[77] und Lachzwängen.[75] Bei häufigem Konsum besteht die Gefahr des Vitamin-B12-Mangels.[74][78] Wiederholt kam es bei dieser Anwendung auch zu Todesfällen.[79]
In den Niederlanden hat die Häufigkeit schwerer Verkehrsunfälle unter Distickstoffmonoxideinfluss stark zugenommen. Distickstoffmonoxid war dort nach Alkohol die bei Schülern meistkonsumierte Rauschdroge.[80] Dies führte dazu, dass am 1. Januar 2023 in den Niederlanden ein Verbot von Distickstoffmonoxid in Kraft gesetzt wurde.[81] Distickstoffmonoxid steht seit diesem Zeitpunkt auf der Liste II des Opiumgesetzes, was bedeutet, dass es dann unter anderem verboten ist, „innerhalb oder außerhalb des Hoheitsgebiets der Niederlande Distickstoffmonoxid zu verbringen, zu verkaufen oder zu besitzen.“[81] Der gewerbliche Einsatz von Distickstoffmonoxid für medizinische und technische Zwecke ist zulässig, ebenso die Verwendung von Distickstoffmonoxid als Zusatz zu Lebensmitteln. Im Vereinigten Königreich unterlag Distickstoffmonoxid dem Psychoactive Substances Act 2016. Damit war es illegal, Distickstoffoxid herzustellen oder einzuführen, der Besitz war jedoch bis dahin nicht strafbar. Seit dem 8. November 2023 wird es als Droge der Klasse C gemäß dem Misuse of Drugs Act 1971 eingestuft, wonach schon der Besitz von Distickstoffmonoxid eine Straftat ist.[82]
In Deutschland ist Distickstoffmonoxid als Partydroge verbreitet. Es ist in Kartuschen abgefüllt in Automaten und an Kiosken erhältlich. In der Politik wird ein Verkaufsverbot an Jugendliche diskutiert.[83]
Nahrungsmitteltechnik

In der Nahrungsmitteltechnik wird Distickstoffmonoxid als zugelassener Lebensmittelzusatzstoff (E 942) aufgrund seiner guten Fettlöslichkeit unter Druck als Treibgas benutzt, vorzugsweise für Milchprodukte, zum Beispiel zum Aufschäumen (statt Schlagen) von Schlagsahne.[84]
Verwendung in der Analytik
In der Atomabsorptionsspektrometrie (AAS) wird bei der Flammen-AAS zum Teil Distickstoffmonoxid anstelle von Luft in einer Acetylen-Flamme zur Erzeugung höherer Temperaturen (2800 °C) verwendet. In der Katalyseforschung wird Distickstoffmonoxid bei der Frontalchromatographie angewendet, um die katalytisch wirksame Kupferoberfläche zu bestimmen.
Raketentechnik
In der Raketentechnik, etwa in Hybridraketen wie dem SpaceShipOne, wird Distickstoffmonoxid als Oxidator eingesetzt. Der Vorteil liegt darin, dass es sich ohne Kühlung durch Druck verflüssigen lässt. Daher wird für den Einsatz in solchen Triebwerken nur ein Drosselventil benötigt, jedoch keine Kraftstoffpumpe oder aufwändige Kryotechnik.[85]
Antriebstechnik

In der Antriebstechnik, etwa bei PKW, wird Distickstoffmonoxid zur Steigerung der Motorleistung von Ottomotoren verwendet, da es mehr Sauerstoff enthält als Luft. Diese sogenannte Lachgaseinspritzung erfordert nur relativ geringe konstruktive Änderungen am Motor und kann seine Leistung kurzfristig um etwa 20 bis 50 % steigern. Das Distickstoffmonoxid wird dabei aus Druckbehältern in den Ansaugtrakt geblasen. Dieses Tuning ist vor allem in den USA verbreitet, seine Verwendung im öffentlichen Straßenverkehr ist aber sowohl dort als auch in Deutschland verboten (mit Ausnahme einer Anlage mit ABE) und den meisten anderen Ländern nur eingeschränkt erlaubt. Die bekanntesten Hersteller von Distickstoffmonoxideinspritzungen sind Nitrous Oxide Systems, NX und Venom sowie ZEX. Im Zweiten Weltkrieg wurden Flugmotoren auf diese Weise in ihrer Leistung gesteigert. Durch das sogenannte GM-1 wurde nicht nur die Motoraufladung verbessert, die Ladeluftkühlung durch die Verdampfung des verflüssigten Distickstoffmonoxids erhöhte auch den thermodynamischen Wirkungsgrad.[86]
Toxikologie
Besondere Gefahren bestehen beim Gebrauch als Rauschmittel: wird Distickstoffmonoxid pur – z. B. aus abgefüllten Ballons –, inhaliert, können als Folgen Dysphorie, Verwirrtheit, Übelkeit, Kopfschmerzen, Schluckauf und Blutdruckabfall auftreten. Bei hohen Mengen kommt es zu einer Unterversorgung des Blutes mit Sauerstoff (Hypoxämie), in deren Folge Kreislaufstillstand, schwere Lähmungen bis hin zur Querschnittslähmung,[87] Hirnschäden und der Tod möglich sind.[88] Falls Distickstoffmonoxid direkt aus dem Gasbehälter eingeatmet wird, kann es zu Erfrierungserscheinungen durch den Joule-Thomson-Effekt an Lippen, Kehlkopf und Bronchien aufgrund der Kälte des Gases kommen. Deshalb werden meist abgefüllte Ballons verwendet.[89]
Unter Anwendung von Distickstoffmonoxid kann es zur Störung der Wirkung von Vitamin B12 und Folsäure kommen und damit zu den Folgen einer perniziösen Anämie. Distickstoffmonoxid oxidiert im Körper Vitamin B12, welches dann als Co-Enzym dem Enzym Methionin-Synthase nicht mehr zur Verfügung steht.[90] So kommt es bei einer Anwendung von Distickstoffmonoxid von über sechs Stunden zu einer Funktionsabnahme der Methionin-Synthase, die für die Produktion vieler wichtiger Proteine wichtig ist.[91] Bei Anwendung bei Patienten mit schweren Störungen der Herzmuskelfunktion besteht die Gefahr von unerwünschten Wirkungen auf das Herz- und Blutgefäßsystem. Zudem kann Distickstoffmonoxid den pulmonalen Gefäßwiderstand steigern.[92]
Nachweis
Für den Nachweis von Distickstoffmonoxid werden chromatographische, spektroskopische und amperometrische Analysenmethoden verwendet. Weit verbreitet ist der Nachweis mittels Gaschromatographie mit einem Elektroneneinfangdetektor. Weiterhin wird die FTIR-Spektrometrie eingesetzt sowie die elektrochemische Bestimmung mittels amperometrischer Sensoren, wobei die Distickstoffmonoxid-Konzentration durch eine Strommessung, der bei der Reduktion von Distickstoffmonoxid an einer Elektrode entsteht, bestimmt wird.[37]
Literatur
- Keith Smith (Hrsg.): Nitrous oxide and climate change. Earthscan, London, 2010, ISBN 978-1-84407-757-1.
- Morris S. Clark, Ann. L. Brunick: Handbook of Nitrous Oxide and Oxygen Sedation. Mosby Elsevier, St. Louis, 2008, ISBN 978-0-323-04827-9.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32.
Einzelnachweise
- ↑ Eintrag zu
 E 942 : Nitrous oxide
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
E 942 : Nitrous oxide
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
- ↑ Eintrag zu
 NITROUS OXIDE in der CosIng-Datenbank.
NITROUS OXIDE in der CosIng-Datenbank.
- ↑ learnmetrics.com:
 "All 16 Refrigerant Types + Lists Of Refrigerants (HFC, HC, HO, etc.)",
Abschnitt: "16. List Of Natural Refrigerants"
"All 16 Refrigerant Types + Lists Of Refrigerants (HFC, HC, HO, etc.)",
Abschnitt: "16. List Of Natural Refrigerants"
- ↑ Hochspringen nach: a b
c d e
f g h
i j k Eintrag zu
 Distickstoffmonoxid, verdichtet in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Distickstoffmonoxid, verdichtet in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ Hochspringen nach: a b c d Eintrag zu Stickstoffoxid. In: Römpp Online. Georg Thieme Verlag.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-51.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Gases, S. 10-254.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 10024-97-2 bzw. Distickstoffmonoxid).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 10024-97-2 bzw. Distickstoffmonoxid).
- ↑ P. Forster, V. Ramaswamy u. a.: Changes in Atmospheric Constituents and in Radiative Forcing.
In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.
Cambridge University Press, Cambridge / New York 2007, S. 212;
(
 online auf ipcc.ch) (PDF; 7,7 MB)
online auf ipcc.ch) (PDF; 7,7 MB)
- ↑
 Bedrohte Ozonschicht: Lachgas ist größeres Problem als
FCKW. In: Spiegel Online. 28. August 2009.
Bedrohte Ozonschicht: Lachgas ist größeres Problem als
FCKW. In: Spiegel Online. 28. August 2009.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 24.
- ↑ Rudolf Frey, Otto Mayrhofer, mit Unterstützung von Thomas E. Keys und John S. Lundy: Wichtige Daten aus der Geschichte der Anaesthesie. In: R. Frey, Werner Hügin, O. Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie und Wiederbelebung. Springer, Heidelberg/Basel/Wien 1955; 2., neubearbeitete und erweiterte Auflage. Unter Mitarbeit von H. Benzer. Springer-Verlag, Berlin/Heidelberg/New York 1971, ISBN 3-540-05196-1, S. 13–16, hier: S. 14.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 33.
- ↑ Christoph Weißer: Lachgas. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 820–821.
- ↑ Imperial College London:
 Nitrous Oxide. In: ch.ic.ac.uk.
Nitrous Oxide. In: ch.ic.ac.uk.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 7–8 und 25.
- ↑ Albert Faulconer, Thomas Edward Keys: Nitrous Oxide. 1965, S. 372–441, hier zitiert: S. 373.
- ↑ Werner Hügin: Anaesthesie. Entdeckung, Fortschritt, Durchbrüche. Editiones ‹Roche›, Basel 1989, ISBN 3-88878-060-8, S. 11–12.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 8 und 25.
- ↑ Edmund Andrews: The oxygen mixture, a new anaesthetic combination. In: Chicago Medical Examiner. Band 9, (November) 1868, S. 656–661.
- ↑ Jörg Weimann:
 Lachgas-Grundlagen: Geschichte. In: lachgas-lehrbuch.de.
Lachgas-Grundlagen: Geschichte. In: lachgas-lehrbuch.de.
- ↑ Albert Faulconer, Thomas Edward Keys: Nitrous Oxide. 1965, S. 373 und 430–437.
- ↑ Edmund Andrews: Liquid Nitrous Oxide as an Anaesthetic. In: Medical Examiner. Band 13, 1872, S. 34–36.
- ↑ M. A. K. Khalil, R. A. Rasmussen: The global sources of nitrous oxide. In:
Journal of Geophysical Research: Atmospheres. 97.D13, 1992, S. 14651–14660,
 doi:10.1029/92jd01222.
doi:10.1029/92jd01222.
- ↑ Hochspringen nach: a b
c H. Tian u. a.: A comprehensive quantification of global nitrous oxide sources and sinks. In:
Nature. 586.7828, 2020, S. 248–256,
 doi:10.1038/s41586-020-2780-0.
doi:10.1038/s41586-020-2780-0.
- ↑ I. M. Orif, Y. N. Kavil, R. K. Al-Farawati, V. Sudheesh: Deoxygenation turns the coastal
Red Sea lagoons into sources of nitrous oxide. In: Marine Pollution Bulletin. 189, 2023, S. 114806,
 doi:10.1016/j.marpolbul.2023.114806.
doi:10.1016/j.marpolbul.2023.114806.
- ↑ V. Kitidis, R. C. Upstill-Goddard, L. G. Anderson: Methane and nitrous oxide in surface
water along the North-West Passage, Arctic Ocean. In: Marine Chemistry. 121.1–4, 2010, S. 80–86,
 doi:10.1016/j.marchem.2010.03.006.
doi:10.1016/j.marchem.2010.03.006.
- ↑ L. M. Ziurys, A. J. Apponi, J. M. Hollis, L. E. Snyder: Detection of interstellar N2O:
A new molecule containing an N-O bond. In: The Astrophysical Journal. 436.2, 1994, S. L181–184,
 doi:10.1086/187662.
doi:10.1086/187662.
- ↑ P. P. Saxena: On the possibility of nitrous oxide (N2O) as a cometary parent molecule in
Comet 1P/Halley. In: Bulletin of the Astronomical Society of India. 32, 2004, S. 185–188, (
 online) (PDF).
online) (PDF).
- ↑
 Overview of Greenhouse Gases | US EPA. In: epa.gov.
Overview of Greenhouse Gases | US EPA. In: epa.gov.
- ↑
 Nitrous oxide emissions – Our World in Data. In: ourworldindata.org.
Nitrous oxide emissions – Our World in Data. In: ourworldindata.org.
- ↑ G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press, 1963, S. 484–485.
- ↑ Patent
 US4376105: Process for producing Nitrous Oxide. Veröffentlicht am
8. März 1983, Erfinder: Hiroshi Matuda u. a..
US4376105: Process for producing Nitrous Oxide. Veröffentlicht am
8. März 1983, Erfinder: Hiroshi Matuda u. a..
- ↑ Ronald M. Heck, Robert J. Farrauto, Suresh T. Gulati: Catalytic Air Pollution Control: Commercial Technology. John Wiley & Sons, 2009, ISBN 978-0-470-27503-0, S. 427–428.
- ↑ Martin Votsmeier u. a.: Automobile Exhaust Control. In:
Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim, 2019,
 doi:10.1002/14356007.a03 189.pub3.
doi:10.1002/14356007.a03 189.pub3.
- ↑ W. B. Bae u. a.: Emission of NH3 and N2O during NO reduction over commercial aged three-way
catalyst (TWC): Role of individual reductants in simulated exhausts. In: Chemical Engineering Journal Advances. 9, 2022, S. 100222,
 doi:10.1016/j.ceja.2021.100222.
doi:10.1016/j.ceja.2021.100222.
- ↑ Hochspringen nach: a b T. D. Rapson, H. Dacres:
Analytical techniques for measuring nitrous oxide. In: Trends in Analytical Chemistry. 54, 2014, S. 65–74,
 doi:10.1016/j.trac.2013.11.004.
doi:10.1016/j.trac.2013.11.004.
- ↑ N. Wrage:
 Grünland als Quelle und Senke für N2O (PDF). Göttingen 2009; abgerufen
(über Bayerische Landesanstalt für Landwirtschaft) am 8. April 2019.
Grünland als Quelle und Senke für N2O (PDF). Göttingen 2009; abgerufen
(über Bayerische Landesanstalt für Landwirtschaft) am 8. April 2019.
- ↑ Pamela Dörhöfer:
 Lachgas-Problem größer als gedacht. In: Klimareporter. 27. November 2019.
Lachgas-Problem größer als gedacht. In: Klimareporter. 27. November 2019.
- ↑ C. C. Ivanovich, T. Sun, D. R. Gordon, I. B. Ocko: Future warming from global food
consumption. In: Nature Climate Change. 13.3, 2023, S. 297–302,
 doi:10.1038/s41558-023-01605-8.
doi:10.1038/s41558-023-01605-8.
- ↑ Jörg Staude:
 Lachgas heizt die Erde mittlerweile mit. In:
Klimareporter.de. 10. Oktober 2020.
Lachgas heizt die Erde mittlerweile mit. In:
Klimareporter.de. 10. Oktober 2020.
- ↑ E. Harris u. a.: Denitrifying pathways dominate nitrous oxide emissions from managed
grassland during drought and rewetting. In: Science Advances. 7.6,
 doi:10.1126/sciadv.abb7118.
doi:10.1126/sciadv.abb7118.
- ↑ C. Skinner u. a.: The impact of long-term organic farming on soil-derived greenhouse
gas emissions. In: Scientific Reports. 9.1, 2019,
 doi:10.1038/s41598-018-38207-w.
doi:10.1038/s41598-018-38207-w.
- ↑ Christoph Dieziger u. a.: Lachgasemissionen aus Faulwasserbehandlung. In:
Aqua & Gas. Nr. 2, 2023, S. 50–54.
 online (PDF; 1,2 MB).
online (PDF; 1,2 MB).
- ↑ Rudolf-Werner Dreier:
 Schwefelatome im Enzym. Albert-Ludwigs-Universität Freiburg im Breisgau, Pressemitteilung vom 15. August 2011 beim
Informationsdienst Wissenschaft (idw-online.de).
Schwefelatome im Enzym. Albert-Ludwigs-Universität Freiburg im Breisgau, Pressemitteilung vom 15. August 2011 beim
Informationsdienst Wissenschaft (idw-online.de).
- ↑ O. HeinemeyerI, M. Kücke, K. Kohrs, E. Schnug, J.C. Munch, E.A. Kaiser:
 Lachgasemissionen beim Rapsanbau. (PDF) In:
thuenen.de.
Lachgasemissionen beim Rapsanbau. (PDF) In:
thuenen.de.
- ↑ Silke Schmidt-Thrö: Lachgas: Wie kann Rapsanbau nachhaltiger werden? In: BR.de. 3. Juni 2015.
- ↑
 Biosprit: Ernüchternde Klimabilanz. In: Zeit Online.
Biosprit: Ernüchternde Klimabilanz. In: Zeit Online.
- ↑
 Antarktis: Lachgasfund an Salzsee verblüfft Forscher.
In: Spiegel Online. 26. April 2010.
Antarktis: Lachgasfund an Salzsee verblüfft Forscher.
In: Spiegel Online. 26. April 2010.
- ↑ C. A. Schutte u. a.: Abiotic Nitrous Oxide Production from Sediments and Brine of Don
Juan Pond, Wright Valley Antarctica, at Mars Analog Temperatures (−40°C). In: Geophysical Research Letters. Band 49, Nr. 3, 2022.
 doi:10.1029/2021gl094635.
doi:10.1029/2021gl094635.
- ↑ Hochspringen nach: a b c d e f A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 705–706.
- ↑ A. H. Mohammadi, D. Richon: Equilibrium Data of Nitrous Oxide and Carbon Dioxide
Clathrate Hydrates. In: Journal of Chemical & Engineering Data. 54.2, 2008, S. 279–281,
 doi:10.1021/je800286t.
doi:10.1021/je800286t.
- ↑ Friedrich R. Kreißl, Otto Krätz: Feuer und Flamme, Schall und Rauch: Schauexperimente und Chemiehistorisches. Wiley-VCH, Weinheim, 2008, ISBN 978-3-527-32276-3, S. 130–132.
- ↑ K. Severin: Synthetic chemistry with nitrous oxide. In:
Chemical Society Reviews. 44.17, 2015, S. 6375–6386,
 doi:10.1039/c5cs00339c.
doi:10.1039/c5cs00339c.
- ↑ K. Hashimoto, H. Tanaka, T. Ikeno, T. Yamada: Selective Nitrous Oxide Oxidation
for C-H Oxidation and Aromatization of 9,10-Dihydroanthracene Derivatives. In: Chemistry Letters. 31.6, 2002, S. 582–583,
 doi:10.1246/cl.2002.582.
doi:10.1246/cl.2002.582.
- ↑ Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 237.
- ↑ C. Smith u. a.: The Earth’s Energy Budget, Climate Feedbacks and Climate Sensitivity.
Supplementary Material, Table 7.SM.7, in: IPCC: Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the
Intergovernmental Panel on Climate Change, Cambridge, UK – New York, NY, USA 2021, S. 16,
(
 online)(PDF; 2,5 MB).
online)(PDF; 2,5 MB).
- ↑ Hochspringen nach: a b R. L. Thompson, L. Lassaletta,
P. K. Patra u. a.: Acceleration of global N2O emissions seen from two decades of atmospheric inversion. In:
Nature Climate Change. 2019,
 doi:10.1038/s41558-019-0613-7
doi:10.1038/s41558-019-0613-7
- ↑ Paul J. Crutzen u. a.: N2O Release from Agro-biofuel Production Negates Global
Warming Reduction by Replacing Fossil Fuels. In: Atmos. Chem. Phys. 8, 2008,
 doi:10.5194/acp-8-389-2008.
doi:10.5194/acp-8-389-2008.
- ↑
 Nitrous oxide emissions pose an increasing climate threat, study finds In:
phys.org.
Nitrous oxide emissions pose an increasing climate threat, study finds In:
phys.org.
- ↑ Guy P. Brasseur, Susan Solomon: Aeronomy of the Middle Atmosphere Chemistry and Physics of the Stratosphere and Mesosphere. Springer, Dordrecht, 2005, ISBN 978-1-4020-3284-4, S. 327.
- ↑ A. R. Ravishankara, J. S. Daniel, R. W. Portmann: Nitrous Oxide
(N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century. In: Science. 326.5949, 2009, S. 123–125,
 doi:10.1126/science.1176985,
doi:10.1126/science.1176985,
 PMID 19713491.
PMID 19713491.
- ↑ M. Dameris, T. Peter, U. Schmidt, R. Zellner: Das Ozonloch und seine Ursachen. In:
Chemie in unserer Zeit. 41.3, 2007, S. 152–168,
 doi:10.1002/ciuz.200700418.
doi:10.1002/ciuz.200700418.
- ↑ H. Tian u. a.: Global nitrous oxide budget (1980–2020). In:
Earth System Science Data. 16.6, 2024, S. 2543–2604,
 doi:10.5194/essd-16-2543-2024.
doi:10.5194/essd-16-2543-2024.
- ↑
 World Health Organization Model List of Essential Medicines – 23rd List,
2023. In: The selection and use of essential medicines 2023: Executive summary of the report of the 24th WHO Expert Committee on the Selection and Use of
Essential Medicines, 24 – 28 April 2023. Geneva: World Health Organization; 2023 (WHO/MHP/HPS/EML/2023.02), (PDF), abgerufen am 18. Juli 2024.
World Health Organization Model List of Essential Medicines – 23rd List,
2023. In: The selection and use of essential medicines 2023: Executive summary of the report of the 24th WHO Expert Committee on the Selection and Use of
Essential Medicines, 24 – 28 April 2023. Geneva: World Health Organization; 2023 (WHO/MHP/HPS/EML/2023.02), (PDF), abgerufen am 18. Juli 2024.
- ↑ Gottfried Alber in: Krankheiten der Katze. Abschnitt 24.5 – Inhalationsanästhesie, Unterabschnitt 24.5.2.2 – Lachgas, S. 631.
- ↑
 Stellungnahme zur
Einführung von Livopan in Deutschland. In: bda.de.
Stellungnahme zur
Einführung von Livopan in Deutschland. In: bda.de.
- ↑ S. Kjilkowitsch: Über das Stickoxydul als Anästhetikum bei Geburten. In: Archiv für Gynäkologie. Band 18, 1881, S. 81 ff.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 9.
- ↑ J. Schulte Am Esch, J. Scholz: [Nitrous Oxide – End of an Era – a
Specific German Discussion] In: Anästhesiologie, Intensivmedizin, Notfallmedizin, Schmerztherapie: AINS, Band 36, Nummer 10, Oktober 2001, S. 597–598,
 doi:10.1055/s-2001-17680.
doi:10.1055/s-2001-17680.
 PMID 11592018.
PMID 11592018.
- ↑ M. K. Vollmer u. a.: Modern inhalation anesthetics: Potent greenhouse gases in the
global atmosphere. In: Geophysical Research Letters. 42.5, 2015, S. 1606–1611,
 doi:10.1002/2014gl062785.
doi:10.1002/2014gl062785.
- ↑ European Society of Anaesthesiology task force on the use of nitrous oxide in clinical
anaesthetic practice: The current place of nitrous oxide in clinical practice: An expert opinion-based task force consensus statement of the European Society of
Anaesthesiology. In: European Journal of Anaesthesiology, Band 32, Nummer 8, August 2015, S. 517–520,
 PMID 26244467.
PMID 26244467.
- ↑ P. S. Myles u. a.; ANZCA Trials Group for the ENIGMA-II investigators: The safety of
addition of nitrous oxide to general anaesthesia in at-risk patients having major non-cardiac surgery (ENIGMA-II): a randomised, single-blind trial. In:
The Lancet, Band 384, Nummer 9952, Oktober 2014, S. 1446–1454.
 PMID 25142708.
PMID 25142708.
- ↑ Hochspringen nach: a b
c
 Lachgas-Missbrauch hat schwere Folgen für die Gesundheit. In:
Innere Medizin und Kardiologie, Innere Medizin und Pneumologie, Neurologie. esanum, 24. März 2022.
Lachgas-Missbrauch hat schwere Folgen für die Gesundheit. In:
Innere Medizin und Kardiologie, Innere Medizin und Pneumologie, Neurologie. esanum, 24. März 2022.
- ↑ Hochspringen nach: a b
c d Leora Koch:
 Partydroge Lachgas – gefährlich oder harmlos? – Lachen bis der Arzt kommt. In:
Detektor.fm – Das Podcast-Radio. 14. August 2019.
Partydroge Lachgas – gefährlich oder harmlos? – Lachen bis der Arzt kommt. In:
Detektor.fm – Das Podcast-Radio. 14. August 2019.
- ↑ Sonja Kempinski:
 Lachgas greift die Nerven an. In: Apotheke.de.
Ärztezeitung.
Lachgas greift die Nerven an. In: Apotheke.de.
Ärztezeitung.
- ↑ Hochspringen nach: a b
 Kurzer Rausch:
Lachgas soll BtM werden. In: Apotheke Adhoc. (deutsch).
Kurzer Rausch:
Lachgas soll BtM werden. In: Apotheke Adhoc. (deutsch).
- ↑ Cyrille De Halleux, David N. Juurlink: Diagnosis and
management of toxicity associated with the recreational use of nitrous oxide. In: Canadian Medical Association Journal.
Band 195,
Nr. 32, 21. August 2023,
S. E1075–E1081,
doi:
 10.1503/cmaj.230196,
10.1503/cmaj.230196,
 PMID 37604519,
PMID 37604519,
 PMC 10442242 (freier Volltext).
PMC 10442242 (freier Volltext).
- ↑
 Laughing gas – teenager dies after party in Bexley. In: BBC News. 26. Juli 2015.
Laughing gas – teenager dies after party in Bexley. In: BBC News. 26. Juli 2015.
- ↑ bbr/dpa:
 Niederlande verbieten ab 2023 Lachgas. In:
Spiegel Online. 15. November 2022.
Niederlande verbieten ab 2023 Lachgas. In:
Spiegel Online. 15. November 2022.
- ↑ Hochspringen nach: a b
 Per-1-januari-2023-verbod-op-lachgas (niederländisch)
Per-1-januari-2023-verbod-op-lachgas (niederländisch)
- ↑
 Nitrous oxide ban: guidance. UK Government, 8. November 2023.
Nitrous oxide ban: guidance. UK Government, 8. November 2023.
- ↑ Cornelia Stenull:
 Lachgas wie Süßigkeiten am Automaten ziehen – Verkaufsverbot an Jugendliche
gefordert, swr.de, 22. Mai 2024
Lachgas wie Süßigkeiten am Automaten ziehen – Verkaufsverbot an Jugendliche
gefordert, swr.de, 22. Mai 2024
- ↑ Frank Massholder:
 Distickstoffmonoxid, was ist das? Treibgase: Definition, Warenkunde, Lebensmittelkunde. In:
lebensmittellexikon.de. 2. Juni 2015.
Distickstoffmonoxid, was ist das? Treibgase: Definition, Warenkunde, Lebensmittelkunde. In:
lebensmittellexikon.de. 2. Juni 2015.
- ↑ V. Zakirov, M. Sweeting, T. Lawrence, J. Sellers: Nitrous oxide as a rocket
propellant. In: Acta Astronautica. 48.5–12, 2001, S. 353–362,
 doi:10.1016/s0094-5765(01)00047-9.
doi:10.1016/s0094-5765(01)00047-9.
- ↑ J. Potthoff, I. C. Schmid: Wehrtechnische Auftragsarbeiten im FKFS.
In: Wunibald I. E. Kamm: Wegbereiter der modernen Kraftfahrtechnik. VDI-Buch. Springer, Berlin, Heidelberg, 2012, S. 233–260,
 doi:10.1007/978-3-642-20303-9 35.
doi:10.1007/978-3-642-20303-9 35.
- ↑ Lachgas ab 2023 in Niederlanden verboten – ZDFheute. In: zdf.de. 15. November 2022.
- ↑ Carola Gessner:
 Partydroge Lachgas. In: medical-tribune.de. 28. Februar 2015.
Partydroge Lachgas. In: medical-tribune.de. 28. Februar 2015.
- ↑ Jan van Amsterdam, Ton Nabben, Wim van den Brink: Recreational nitrous oxide
use: Prevalence and risks. In: Regulatory toxicology and pharmacology: RTP.
Band 73,
Nr. 3, 22. Oktober 2015,
S. 790–796,
doi:
 10.1016/j.yrtph.2015.10.017,
10.1016/j.yrtph.2015.10.017,
 PMID 26496821.
PMID 26496821.
- ↑ R. D. Sanders, J. Weimann, M. Maze: Biologic effects of nitrous oxide: a mechanistic and toxicologic
review. In: Anesthesiology. Band 109, Nr. 4, Oktober 2008, S. 707–722.
 doi:10.1097/ALN.0b013e3181870a17.
doi:10.1097/ALN.0b013e3181870a17.
 PMID 18813051 (Review).
PMID 18813051 (Review).
- ↑ J. Weimann: Toxicity of nitrous oxide. In: Best practice & research. Clinical anaesthesiology.
Band 17, Nummer 1, März 2003, S. 47–61.
 PMID 12751548 (Review).
PMID 12751548 (Review).
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin / Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 14–16 und 516.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 18.11. 2025


