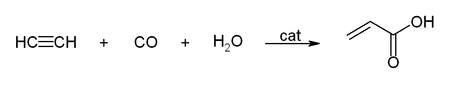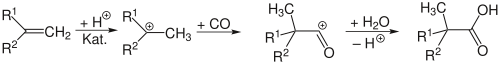Kohlenstoffmonoxid
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| MAK | DFG/Schweiz: 30 ml/m3 bzw. 35 mg/m3 | |||||||||
| Toxikologische Daten | ||||||||||
Kohlenstoffmonoxid (fachsprachlich Kohlenstoffmonooxid, gebräuchlich Kohlenmonoxid) ist eine chemische Verbindung aus Kohlenstoff und Sauerstoff mit der Summenformel CO. Kohlenstoffmonoxid ist ein farb-, geruch- und geschmackloses sowie toxisches Gas. Es entsteht unter anderem bei der unvollständigen Verbrennung von kohlenstoffhaltigen Stoffen bei unzureichender Sauerstoffzufuhr. Formal ist das Gas das Anhydrid der Ameisensäure, trotzdem löst es sich kaum in Wasser.
Kohlenstoffmonoxid ist brennbar und verbrennt mit Sauerstoff in blauer, durchsichtiger Flamme zu Kohlenstoffdioxid. Es ist bei erhöhter Temperatur sehr reaktiv und reagiert mit verschiedenen Übergangsmetallen zu Metallcarbonylen. Mit Schwefel reagiert Kohlenstoffmonoxid zu Carbonylsulfid, mit Alkali-Hydroxiden zu Formiaten, mit Halogenen wie Fluor bzw. Chlor reagiert es zu Carbonylhalogeniden wie Carbonylfluorid bzw. Phosgen. Mit Azoverbindungen reagiert Kohlenstoffmonoxid zu Isocyanaten und mit Ammoniak zum giftigen Formamid. Als Bestandteil des Synthesegases reagiert es in der Fischer-Tropsch-Synthese zu verschiedenen Kohlenwasserstoffen und deren Oxidationsprodukten. Weiterhin wird es zur Synthese von Methanol und Isobutanol verwendet. Als Bestandteil des Stadtgases wurde es in Deutschland bis in die zweite Hälfte des 20. Jahrhunderts als Brenn- und Leuchtgas eingesetzt.
Das Gas ist giftig, da es stärker an Hämoglobin bindet als Sauerstoff und so den Sauerstofftransport durch das Blut unterbindet. Die Kohlenstoffmonoxidintoxikation ist häufig ein Teilvorgang der Rauchgasvergiftung und der Minenkrankheit nach Einatmung giftiger Gase im Bergbau; sie kann innerhalb kurzer Zeit tödlich sein.
| Strukturformel | |
|---|---|
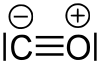 | |
| Allgemeines | |
| Name | Kohlenstoffmonoxid |
| Andere Namen |
|
| Summenformel | CO |
| Kurzbeschreibung | farb- und geruchloses Gas |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 630-08-0 |
| EG-Nummer | 211-128-3 |
| ECHA-InfoCard | 100.010.118 |
| PubChem | 281 |
| ChemSpider | 275 |
| DrugBank | DB11588 |
| Eigenschaften | |
| Molare Masse | 28,01 g/mol |
| Aggregatzustand | gasförmig |
| Dichte | 1,25 kg/m3 (0 °C, 1013 mbar) |
| Schmelzpunkt | −205,07 °C |
| Siedepunkt | −191,5 °C |
| Löslichkeit | 30 mg/l in Wasser (20 °C) |
| Dipolmoment | 0,10980 D (3,663 · 10−31 C · m) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −110,527 kJ/mol. |
Nomenklatur
In der zurückgezogenen deutschen Norm DIN 32640 „Chemische Elemente und einfache anorganische Verbindungen – Namen und Symbole“ vom Dezember 1986 wird die Schreibweise „Kohlenstoffmonooxid“ mit „oo“ empfohlen, weil nach den IUPAC-Regeln für die Nomenklatur der anorganischen Chemie Endvokale vorangestellter griechischer Zahlwörter nicht weggelassen werden.
Dagegen wird in der Ausgabe der IUPAC-Nomenklatur von 1990 die Schreibweise „Kohlenstoffmonoxid“ genannt. Zur Verwendung der multiplikativen Präfixe heißt es: „Die abschließenden Vokale der multiplikativen Präfixe werden nicht weggelassen, es sei denn, es liegen zwingende sprachliche Gründe vor. Monoxid ist eine derartige Ausnahme.“
Geschichte
Schon im Jahr 1000 v. Chr. wurde bei der Verhüttung von Metallerzen die reduzierende Wirkung von Kohlenstoffmonoxid in sogenannten Rennöfen genutzt, ohne jedoch die Natur des Gases zu kennen. Die Griechen und Römer verwendeten es für Exekutionen. Arnaldus de Villanova beschrieb im späten 13. Jahrhundert die Giftigkeit eines Gases, das durch die Verbrennung von Holz entsteht; gemeint war Kohlenstoffmonoxid. Im frühen 17. Jahrhundert experimentierte Johan Baptista van Helmont mit einem Gas namens gas carbonum, einer Mischung aus Kohlenstoffdioxid und Kohlenstoffmonoxid.
Im Jahr 1776 erzeugte der französische Chemiker Joseph de Lassone Kohlenstoffmonoxid durch Erhitzen von Zinkoxid mit Koks. Er nahm fälschlicherweise an, dass es sich dabei um Wasserstoff handele. Joseph Priestley stellte 1799 Kohlenstoffmonoxid durch Überleiten von Kohlenstoffdioxid über heißes Eisen her. William Cruickshank nutzte das gleiche Verfahren im Jahr 1800. Er schlug die richtige Zusammensetzung CO vor. Die toxischen Eigenschaften auf Hunde wurden von Claude Bernard um 1846 untersucht.
Anfang des 19. Jahrhunderts wuchs der Bedarf an Leuchtgasen. Die englische Leuchtgasindustrie begann zu dieser Zeit mit der Entwicklung von Verfahren zur Kohlevergasung. Mit der Entwicklung von Hochdruckverfahren in der chemischen Industrie zu Beginn des 20. Jahrhunderts stieg der Bedarf an kohlenstoffmonoxidhaltigen Synthesegasen stark an. Mit der Entwicklung des Winkler-Generators, des Lurgi-Druckvergasers und später des Koppers-Totzek-Reaktors gelang die großtechnische Kohlevergasung.
Während der Zeit des Nationalsozialismus wurde Kohlenstoffmonoxid für Exekutionen verwendet. Bei der Aktion T4 wurden mit Kohlenstoffmonoxid systematisch mehr als 70.000 Menschen mit geistigen und körperlichen Behinderungen von 1940 bis 1945 in Deutschland ermordet.
Vorkommen
Atmosphärische Vorkommen
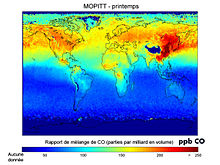
Die mittlere Konzentration von Kohlenstoffmonoxid in der Erdatmosphäre beträgt etwa 90 Milliardstel Volumenanteil (die englische Bezeichnung für ein Milliardstel ist parts per billion; mit dem Zusatz „v“ für Volumenanteil wird diese Hilfseinheit üblicherweise als „ppbv“ abgekürzt). Insgesamt enthält die Atmosphäre etwa 400 Megatonnen (Mt). Auf der Nordhalbkugel liegt die mittlere Konzentration heute bei 140 ppbv, vor der Industrialisierung waren es etwa 90 ppbv. Auf der Südhalbkugel blieb die mittlere Konzentration mit 50 ppbv auf ihrem natürlichen Niveau.
Das Satelliten-Instrument Terra’s Measurements Of Pollution In The Troposphere (MOPITT) erstellte die erste globale Karte für die CO-Konzentration in der niedrigeren Erdatmosphäre. Die MOPITT-Abbildung anbei zeigt die durchschnittliche CO-Konzentration von April, Mai und Juni für die Jahre 2000 bis 2004.
Kohlenstoffmonoxid hat eine mittlere atmosphärische Lebensdauer von etwa zwei Monaten. Die wichtigste Reaktion ist die mit Hydroxyl-Radikalen in der Atmosphäre, wodurch jährlich 2300 Mt (2000–2800 Mt) Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidiert werden. Böden tragen zur CO-Oxidation mit etwa 300 Mt (200–600 Mt) jährlich bei. Die Oxidationsgeschwindigkeit hängt von der Konzentration der Hydroxyl-Radikale ab, die mit stärkerer Sonneneinstrahlung und höherem Wasserdampfgehalt zunimmt. In den Tropen beträgt die Lebensdauer etwa einen Monat, in gemäßigten und nördlichen Breiten bewegt sie sich zwischen zwei Monaten im Sommer und mehr als einem Jahr im Winter. Für den Ausgleich der Kohlenstoffmonoxidkonzentrationen zwischen Nord- und Südhalbkugel wäre eine mittlere atmosphärische Lebensdauer von ungefähr einem Jahr erforderlich. Die höheren anthropogenen Emissionen auf der Nordhalbkugel führen daher zu einem deutlichen Konzentrationsunterschied zwischen den Hemisphären. Durch Wettereinflüsse wie den indischen Monsun und durch Emissionen von Ballungszentren gibt es regional, etwa in Ostasien, erhebliche Konzentrationsunterschiede.
Weltweit gelangen jährlich etwa 2500 Megatonnen (2000–2900 Mt) Kohlenstoffmonoxid in die Atmosphäre oder werden dort gebildet. Etwa die Hälfte davon entsteht bei der unvollständigen Verbrennung fossiler Brennstoffe oder von Biomasse, auch bei Wald- und Buschbränden. Ein weiterer großer Anteil wird erst in der Atmosphäre durch die Oxidation von Kohlenwasserstoffen wie Methan oder anderen flüchtigen organischen Verbindungen gebildet. Insgesamt sind etwa 60 % des Kohlenstoffmonoxids vom Menschen verursacht, der Rest ist natürlichen Ursprungs.
Angaben zu den globalen Emissionsraten beruhen auf Schätzungen und sind mit Unsicherheitsfaktoren behaftet. So werden die Kohlenstoffmonoxid-Emissionen aus dem Verkehr mit 500 Mt (300–600 Mt) angegeben, stationäre Anlagen zur Energiegewinnung aus fossilen Brennstoffen emittieren 100 Mt (80–200 Mt), die Biomasseverbrennung 600 Mt (300–800 Mt). Durch die Oxidation von Methan entstehen 600 Mt (400–800 Mt), beim Abbau anderer flüchtiger organischer Verbindungen 500 Mt (300–700 Mt). Weitere biogene Quellen setzen etwa 200 Mt (100–400 Mt), Böden etwa 30 Mt und die Ozeane etwa 10 Mt jährlich frei.
Böden können sowohl Quellen als auch Senken für Kohlenstoffmonoxid sein. In Trockengebieten geben Böden Kohlenstoffmonoxid ab, vermutlich durch die abiotische Zersetzung organischer Substanz unter dem Einfluss von Licht und hohen Temperaturen. Außerhalb der Trockengebiete überwiegt der Abbau durch Prokaryoten, abhängig vom Sauerstoff- und Wassergehalt des Bodens entweder durch Reduktion zu Methan (Methanbildner) oder durch die Oxidation zu Kohlendioxid.
Ozeane sind in Bezug auf Kohlenstoffmonoxid übersättigt. Im Atlantischen Ozean beträgt die Konzentration etwa das zehn- bis vierzigfache der atmosphärischen Gleichgewichtskonzentration, wobei biologische Quellen als Verursacher angenommen werden. Die Ozeane stellen demnach eine Quelle atmosphärischen Kohlenstoffmonoxids dar, deren Anteil auf 5 bis 29 % der durch Verbrennung freigesetzten Menge geschätzt wird.
In den Gasen hawaiianischer Vulkane wurde eine Konzentration von 3700 ppm (parts per million) Kohlenstoffmonoxid gemessen. Für die globale Bilanz spielen Vulkane keine Rolle.
Die Hauptinfrarotabsorptionsbande des Kohlenstoffmonoxids liegt bei einer Wellenzahl von 2143 cm−1 (Wellenlänge etwa 4,67 µm) und damit weit vom spektralen Maximum der Infrarotstrahlung der Erde, die bei einer Wellenzahl von ungefähr 1000 cm−1 (10 µm) liegt, entfernt. Kohlenstoffmonoxid trägt daher durch direkte Absorption nur wenig zum Treibhauseffekt bei. In der Troposphäre erfolgt die Oxidation von Kohlenwasserstoffen wie Methan zu Kohlenstoffdioxid ebenfalls über Hydroxyl-Radikale. Als Zwischenprodukt entsteht bei der Methanoxidation ebenfalls Kohlenstoffmonoxid. Der Effekt des Kohlenstoffmonoxids bezüglich des Treibhauseffekts liegt in seiner Bedeutung als Senke für diese Hydroxyl-Radikale, die dadurch der Umwandlung von direkten Treibhausgasen wie Methan nicht mehr zur Verfügung stehen. Auch Methanol, nach Methan das zweithäufigste organische Gas in der Erdatmosphäre, das in Konzentrationen von 0,1 bis 10 ppbv vorkommt, ist eine bedeutende atmosphärische Quelle für Kohlenstoffmonoxid, wobei ein Großteil des Methanols von Pflanzen emittiert wird.
In städtischen Umgebungen können durch unbehandelte Autoabgase die Werte zwischen 100 und 200 ppm liegen. Die Konzentration von Kohlenstoffmonoxid im unverdünnten Abgas eines Automobils ohne Abgaskatalysator beträgt etwa 7000 ppm. Bei Fahrzeugen mit Drei-Wege-Katalysator und richtig eingestellter Lambdasondenregelung dient Kohlenstoffmonoxid im Idealfall zur Reduktion der Stickoxide, wobei es selbst zu Kohlenstoffdioxid oxidiert wird. Durch hohe Abgastemperaturen und die damit verbundene Einstellung des Boudouard-Gleichgewichts enthalten Abgase von Personenkraftwagen mit Ottomotor immer einen gewissen Anteil an Kohlenstoffmonoxid. In den Abgasnormen Euro 5 und 6 ist ein Grenzwert von 1000 ppm festgelegt, für Fahrzeuge mit Dieselmotor beträgt der Grenzwert 500 ppm. In den Vereinigten Staaten ging im Jahr 2002 mehr als die Hälfte der troposphärischen Kohlenstoffmonoxidemissionen auf den Betrieb von Fahrzeugen zurück, etwa 61 von 117 Millionen Tonnen. In Ballungsgebieten waren Abgase von Fahrzeugen für etwa 75 % aller Kohlenstoffmonoxidemissionen verantwortlich. Der Kohlenstoffmonoxid-Ausstoß dieser mobilen Quellen ist seit Anfang der 1990er Jahre um etwa 5 % pro Jahr rückläufig.
Kohlenstoffmonoxid, Stickoxide und flüchtige Kohlenwasserstoffverbindungen sind die Vorläufermoleküle für die Bildung von Ozon (O3) in der Troposphäre. Die Ozonbildung erfolgt über die Oxidation von Stickstoffmonoxid (NO) zu Stickstoffdioxid (NO2) durch Peroxyradikale, die zum Beispiel bei der Oxidation von Kohlenstoffmonoxid gebildet werden. Diese reagieren sehr schnell mit vorhandenem Stickstoffmonoxid unter Bildung von Stickstoffdioxid. Durch Photolyse des Stickstoffdioxids entsteht Ozon.
Die Verteilung sowie die Quellen und Senken von Kohlenstoffmonoxid unterscheiden sich zwischen der Troposphäre und der Stratosphäre. In der Stratosphäre entsteht fortlaufend durch Kernreaktionen das Kohlenstoff-Isotop 14C, etwa wenn das mit Abstand häufigste Stickstoff-Isotop 14N von einem Neutron getroffen wird. Wird ein Neutron eingefangen und dafür ein Proton abgespalten, entsteht aus dem 14N-Kern ein 14C-Kern. Der entstehende Kohlenstoff wird zunächst zu Kohlenstoffmonoxid oxidiert. Die Verweilzeit des Kohlenstoffmonoxids in der Stratosphäre hängt unter anderem von der Konzentration von Hydroxyl-Radikalen ab, durch die es zum Kohlenstoffdioxid oxidiert wird.
Vorkommen in Gebäuden
In Wohngebäuden liegt die normale Konzentration bei 0,5 bis 5 ppm, wobei in der Nähe von Gasbrennern Konzentrationen von bis zu 15 ppm auftreten können. Auch Tabakrauch enthält signifikante Konzentrationen von Kohlenstoffmonoxid. Zehn gerauchte Zigaretten erhöhen in einem ungelüfteten, 30 m³ großen Raum die Konzentration um etwa 22 ppm Kohlenstoffmonoxid.
Kohlenstoffmonoxid hat eine Dichte von 96,5 % der Dichte von Luft, ist also geringfügig leichter.
Trotz dichter Abgassysteme können Installationsfehler und mangelnde Wartung auch bei modernen (raumluftunabhängig betriebenen) Heizkesseln zum Austritt von Kohlenmonoxid führen.
Bei raumluftabhängig betriebenen Feuerstätten wie Kachel- und Kaminöfen, Gas-Durchlauferhitzern und älteren Gasthermen, wird das bei unvollständiger Verbrennung entstehendes Kohlenstoffmonoxid mit dem warmen Abgas über den Kamin abgeführt, solange ein ausreichender Kaminzug gegeben ist. Bei schlechtem Kaminzug kann das entstehende Kohlenstoffmonoxid in die Raumluft gelangen und zu Vergiftungen führen.
Die Gründe für eine Abgas-Rückströmung oder deren ungenügende Abführung sind vielfältig. So kann Wind einen Gegendruck im Schornstein verursachen. Lüftungsanlagen, eingeschaltete Dunstabzugshauben oder Zentralstaubsaugeranlagen können einen Unterdruck in Innenräumen bewirken, der ebenfalls zu einer Abgas-Rückströmung führen kann. Undichte Kamine und Öfen, falsch bemessene oder etwa durch Wespen- oder Vogelnester blockierte Kamine können den Abzug der Abgase verhindern.
Weitere Quellen für Kohlenstoffmonoxid in Wohnräumen sind das Grillen über Holzkohle, Holzfeuer, oder der Betrieb von mit Propangas befeuerten Heizstrahlern. Auch Gasherde, Emissionen aus Holzpellets in Pelletbunkern, Autoabgase von unterhalb gelegenen Garagen und die Verwendung von mit Verbrennungsmotoren betriebenen Belüftungsgeräten und Generatoren können Kohlenstoffmonoxidquellen sein.
Extraterrestrische Vorkommen

Auch im extraterrestrischen Raum, dem Weltraum außerhalb der Erde und ihrer Atmosphäre, ist Kohlenstoffmonoxid weit verbreitet. Es entsteht dort, wenn das viel seltenere Kohlenstoffdioxid mit atomarem und molekularem Wasserstoff zu Wasser und Kohlenstoffmonoxid reagiert. Daneben gibt es eine Reihe weiterer Bildungsreaktionen, wie etwa die Reaktion von Kohlenstoffkationen mit Hydroxyl-Radikalen unter Bildung von Kohlenstoffmonoxid und einem Proton.
Kohlenstoffmonoxid wurde in der Photosphäre der Sonne und den Atmosphären von Venus, Mars, Jupiter, Saturn, Titan, Uranus und Neptun nachgewiesen. Die Kohlenstoffmonoxidkonzentration in der Venusatmosphäre beträgt etwa 50 ppm, in der Marsatmosphäre wurden 700 ppm gemessen. Im äußeren Sonnensystem kommt Kohlenstoffmonoxid als zweithäufigster Bestandteil in der äußerst dünnen Atmosphäre des Zwergplaneten Pluto vor. Auch in der Atmosphäre von Exoplaneten wurde Kohlenstoffmonoxid nachgewiesen.
In den Gasemissionen des Kometen Halley maß die Raumsonde Giotto 10 % Kohlenstoffmonoxid. Auch in den Emissionen anderer Kometen wie Hyakutake, Hale-Bopp, und Schwassmann-Wachmann 1 wurde Kohlenstoffmonoxid nachgewiesen. Diese Beobachtungen führten zu dem Schluss, dass Kohlenstoffmonoxid eine maßgebliche Kohlenstoffquelle während der Bildung des Sonnensystems bildete. Über Fischer-Tropsch-artige Reaktionen bildeten sich aus Kohlenstoffmonoxid und Wasserstoff in der Urzeit des Sonnensystems komplexere organische Moleküle wie Kohlenwasserstoffe und Fettsäuren, die möglicherweise in Zusammenhang mit dem Ursprung des Lebens stehen.
Eine wichtige Emissionslinie des interstellar in Molekülwolken vorkommenden Kohlenstoffmonoxids liegt bei einer Wellenlänge von 2,6 mm und wird größtenteils durch Stöße mit Wasserstoff-Molekülen angeregt. Die Infrarot- und Radiobeobachtung von Kohlenstoffmonoxid in Molekülwolken dient daher zur indirekten Bestimmung der interstellaren Wasserstoffkonzentration. Dabei wird angenommen, dass das Verhältnis von Kohlenstoffmonoxid und Wasserstoff konstant ist. Rotationsübergänge von Kohlenstoffmonoxid sind ein effizienter Mechanismus für die Umwandlung von thermischer Energie in Mikrowellen- und Infrarotstrahlung und gehören zu den wichtigen Kühlmechanismen von Molekülwolken. Diese Energieverluste erleichtern in den genügend dichten Bereichen einer Molekülwolke die Bedingungen für das Eintreten eines Gravitationskollapses einer Molekülwolke, was zur Sternentstehung führen kann. In seiner Eigenschaft als Indikator für das Vorkommen von Wasserstoff gehört Kohlenstoffmonoxid zu den meistuntersuchten interstellar vorkommenden Molekülen. Durch Messung der Rotverschiebung der Rotationsübergänge von Kohlenstoffmonoxid konnte dessen Verteilung und Kinematik innerhalb der galaktischen Äquatorialebene ermittelt werden.
Gewinnung und Darstellung
Kohlenstoffmonoxid kann aus zahlreichen kohlenstoffhaltigen Rohstoffen wie z.B. Erdgas, Biogas, Leichtbenzin, Schwerölen, Kohle oder Biomasse hergestellt werden. Ist der Rohstoff Kohle oder Koks, wird zunächst Generatorgas (enthält etwa 25 % CO neben N2), Wassergas (CO:H2 etwa 1:1) oder Synthesegas (CO:H2 etwa 1:2) erzeugt, das gereinigt und aufbereitet wird. Methan als Rohstoff führt zu Spaltgas (CO:H2 etwa 1:3). Die wichtigsten großtechnischen Verfahren sind die Kohlevergasung, die Dampfreformierung (Steam Reforming) und die partielle Oxidation von Kohlenwasserstoffen.
Kohlevergasung
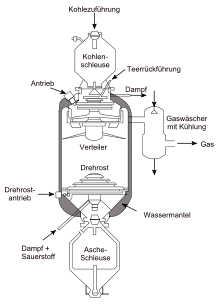
Die Kohlevergasung erfolgt in sogenannten Generatoren, die je nach Prozessführung Generatorgas, Wassergas oder Synthesegas herstellen können. Die verwendeten Generatorarten sind vielfältig und unterscheiden sich unter anderem in der Art der Kohlezuführung, der Schlackenabführung und der verwendeten Kohlen und deren Korngrößen. Neben dem Abstichgenerator, dem Festrostgenerator und dem Drehrostgenerator sind der Winkler-Generator, der Lurgi-Druckvergaser und der Koppers-Totzek-Reaktor gebräuchlich, wobei die letzteren drei hauptsächlich zur Gewinnung von Synthesegas verwendet werden. In Schwelgeneratoren werden neben den Gasen noch Teer und durch Kohlenwasserstoffe angereicherte Gase erhalten.
Wasser- und Synthesegasherstellung
Koks wird bei erhöhter Temperatur vergast, indem er mit Wasserdampf und Luft oder vorzugsweise Sauerstoff umgesetzt wird. Durch die Prozessführung kann die Gaszusammensetzung bestimmt werden. Im Wechselbetrieb zwischen Luft (Blaseperiode oder einfach „Blasen“) und Wasserdampf (Gasperiode oder „Gasen“) wird Wassergas erzeugt, wobei nur das während der Reaktion mit Wasserdampf erzeugte Gas verwendet wird. Der Betrieb mit Luft dient dem Heißblasen des Kokses bis zur Weißglut und damit der Bereitstellung der notwendigen Energie für die endotherme Wassergasreaktion. Werden die Generatoren kontinuierlich mit Luft oder Sauerstoff und Wasser betrieben, ist Synthesegas das Hauptprodukt.
Die Veränderung des Energiegehaltes des Systems, der Enthalpie ,
wird durch das Symbol
ausgedrückt, wobei endotherme
Reaktionen gemäß der Konvention ein positives Vorzeichen haben. Der Exponent
Null steht für die Standardbedingungen
(100 kPa und 25 °C). Während die Enthalpie angibt, ob ein Prozess exotherm
oder endotherm verläuft, ist die Änderung
der Gibbs-Energie während
einer chemischen
Reaktion das entscheidende Kriterium dafür, ob eine Umsetzung der
beteiligten Stoffe tatsächlich freiwillig abläuft.
Die Hauptreaktion ist die endotherme heterogene Wassergasreaktion:
Diese ist mit der exothermen Verbrennung von Kohlenstoff gekoppelt:
Außerdem sind noch weitere Reaktionen beteiligt. Die wichtigsten sind das Boudouard-Gleichgewicht
und die homogene Wassergasreaktion (Wassergas-Shift-Reaktion)
Generatorgasherstellung
Generatorgas entsteht durch unvollständige Verbrennung von Koks. Dazu wird Luft durch eine Kohleschicht geleitet und im Luftüberschuss zunächst zu Kohlenstoffdioxid verbrannt. Das Kohlenstoffdioxid reagiert dann bei hohen Temperaturen mit Kohlenstoff zu Kohlenstoffmonoxid. Das Generatorgas hat eine Zusammensetzung von etwa 70 % Stickstoff, 25 % Kohlenstoffmonoxid und 4 % Kohlendioxid. Daneben enthält das Gas Wasserstoff, Methan und Sauerstoff.
Holzvergasung
Holzgas besteht zu ca. 34 % aus Kohlenmonoxid. Bei der Herstellung von Holzgas wird Holz auf über 150 °C bei geringer Luftzufuhr erhitzt, sodass einige Bestandteile, vor allem Cellulose teilweise verbrennen. Dabei verbleibt ein teerartiges Holzgaskondensat.
Dampfreformierung
Kohlenstoffmonoxid kann durch Behandlung von Erdgas oder leichten Erdöl-Fraktionen mit Wasserdampf erzeugt werden, zum Beispiel aus Methan nach
oder allgemein nach
Das Hauptprodukt der Dampfreformierung ist Wasserstoff. Die endotherme Reaktion läuft in Gegenwart von Nickelkatalysatoren bei Temperaturen von 700 bis 1100 °C ab. Die Reaktion ist reversibel.[70]
Partielle Oxidation von Kohlenwasserstoffen
Bei der partiellen Oxidation wird das Ausgangsmaterial, zum Beispiel schweres Heizöl, mit einer begrenzten Menge Sauerstoff zu Wasserstoff und Kohlenstoffmonoxid oxidiert. Dabei wird zwischen thermisch und katalytisch partieller Oxidation unterschieden. Bei thermisch partieller Oxidation beträgt die Reaktionstemperatur etwa 1200 °C, bei katalytischen Verfahren je nach Katalysator etwa bei 800 bis 900 °C:
Labormaßstab

Im Labor lässt sich ein gleichmäßiger Strom von Kohlenstoffmonoxid durch Eintropfen von Ameisensäure in warme, konzentrierte Schwefel- oder Phosphorsäure herstellen:
Alternativ kann die Ameisensäure auch auf Phosphorpentoxid, dem Anhydrid der Phosphorsäure, getropft werden.
Da Kohlenstoffmonoxid sehr giftig ist, müssen überschüssige Mengen mit speziellen Absorbern aufgefangen oder mit einer Abflammvorrichtung abgeflammt werden. Besondere Vorsicht ist bei Kohlenstoffmonoxid-Luft-Gemischen geboten, da diese explosiv reagieren können. Zusätzlich besteht die Möglichkeit, Kohlenstoffmonoxid mit Kupfer(II)-oxid oder Hopcalite katalytisch zu Kohlenstoffdioxid umzusetzen.
Abtrennung des Kohlenstoffmonoxids
Wenn reine Gase als Produkt erwünscht sind, muss das wie oben beschriebene Gasgemisch aufgetrennt werden. Für viele Anwendungen wird hingegen direkt Synthesegas benötigt, hier muss nur das Verhältnis zwischen Kohlenstoffmonoxid und Wasserstoff nach Erfordernis angepasst werden. Das Kohlenstoffmonoxid kann auf den folgenden Wegen abgetrennt werden:
- Reversible Komplexierung an Kupfer-Aluminium-Salzen bei erhöhtem Druck; bei erniedrigtem Druck wird das Kohlenstoffmonoxid wieder freigesetzt.
- Kondensation bei niedrigen Temperaturen
- Druckwechsel-Adsorption
- Semipermeable Membranen
Eigenschaften
Physikalische Eigenschaften
Kohlenstoffmonoxid ist ein farb- und geruchsloses Gas mit der molaren Masse von 28,01 g/mol. Mit 1,25 kg/m³ weist es fast dieselbe Dichte wie Luft auf. Der Siedepunkt von −191 °C und der Schmelzpunkt von −205 °C liegen nahe an den Werten des isoelektronischen (s.u.) Stickstoffs, der einen Siedepunkt von −196 °C und einen Schmelzpunkt von −210 °C aufweist.
Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht sind, liegt bei einer Temperatur von −205,0 °C und einem Druck von 0,154 bar. Die kritische Temperatur beträgt −140,2 °C, der kritische Druck liegt bei 35,0 bar, die kritische Dichte bei 0,301 g/cm³.
Kohlenstoffmonoxid bildet beim Abkühlen zunächst eine feste, ungeordnete, hexagonale β-Phase, die bei weiterem Abkühlen unter 61,6 K in eine geordnete α-Phase übergeht, die im kubischen Kristallsystem mit der Raumgruppe P213 (Raumgruppen-Nr. 198) kristallisiert. Bei hohen Drücken von über 52.000 bar bilden sich feste, weißliche, gelbliche oder rote, metastabile Polycarbonylphasen, deren genaue Struktur noch unbekannt ist.
Kohlenstoff und Sauerstoff sind im Kohlenstoffmonoxidmolekül sehr fest aneinander gebunden. Die Dissoziations ist noch etwas höher als die des sehr inerten, zu Kohlenstoffmonoxid isoelektronischen Distickstoffmoleküls, und liegt bei 1070,3 kJ/mol. Für die Spaltung des Stickstoffmoleküls N2 sind nur 946 kJ/mol erforderlich.
Der massebezogene Heiz- und Brennwert beträgt 10,1 MJ/kg und ist damit etwa 5 Mal kleiner als derjenige von Methan. Der volumenbezogene Heiz- und Brennwert beträgt 12.636 kJ/m³ und liegt damit im Bereich des Wasserstoffs. Die Zündtemperatur liegt bei 605 °C. Der Zündbereich reicht von 12,5 bis 75 Vol.-% Kohlenstoffmonoxid in Luft.
Molekulare Eigenschaften
Die Bindungslänge zwischen dem Kohlenstoff- und Sauerstoffatom beträgt in der Festphase 106 pm und in der Gasphase 112,8 pm. Der Kernabstand zweier gegebener Atome ist um etwa 20 pm geringer, wenn diese mit einer Doppelbindung statt einer Einfachbindung verbunden sind.
Für eine Dreifachbindung ist der Abstand um weitere 10 pm kleiner als der einer Doppelbindung. Die im Vergleich zu einer Kohlenstoff-Sauerstoff-Doppelbindung einer organischen Carbonylverbindung, zum Beispiel beim Formaldehyd, etwa 10 pm kürzere Kohlenstoff-Sauerstoff-Bindung weist daher auf eine Dreifachbindung hin.
-
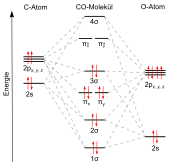 Energieniveauschema der σ- und π-Molekülorbitale des Kohlenstoffmonoxids
Energieniveauschema der σ- und π-Molekülorbitale des Kohlenstoffmonoxids
Die Molekülstruktur wird am besten mit der Molekülorbitaltheorie beschrieben. Entsprechend deren Regeln ist die Anzahl der resultierenden Molekülorbitale gleich der Anzahl der beteiligten Atomorbitale. Aus den je vier Atomorbitalen des Kohlenstoffs und des Sauerstoffs bilden sich die acht Molekülorbitale des Kohlenstoffmonoxids. Das besetzte Molekülorbital höchster Energie (HOMO) bildet das antibindende σs*-Orbital. Bei antibindenden Orbitalen liegt die höchste Aufenthaltswahrscheinlichkeit der Elektronen nicht zwischen den beteiligten Atomkernen. Dadurch wird die Abstoßung der positiv geladenen Atomkerne nicht abgeschirmt. Die Molekülorbitale werden deshalb antibindend genannt. Die unbesetzten Molekülorbitale niedrigster Energie (LUMO) sind die antibindenden πx,y*-Orbitale.
Im Grundzustand befindet sich das Molekül in einem Singulettzustand, das heißt, es treten keine ungepaarten Elektronen im Molekül auf. In der Lewis-Strukturformel tritt am Sauerstoffatom eine positive und am Kohlenstoffatom eine negative Formalladung auf:
![]()
Durch die hohe Elektronegativitätsdifferenz von 1 zwischen den Bindungspartnern wird diese Formalladung wieder ausgeglichen und Kohlenstoffmonoxid ist daher nahezu unpolar. Sein Dipolmoment beträgt lediglich μ = 0,10980 D, wobei das Dipolmoment so gerichtet ist, dass das Sauerstoffatom die positive Ladung trägt.
Chemische Eigenschaften
Die Bildung von Kohlenstoffmonoxid aus den Elementen ist exotherm und steht in einem Disproportionierungsgleichgewicht mit Kohlenstoff und Kohlenstoffdioxid. Weil sich dieses Gleichgewicht bei Raumtemperatur nur fast unmessbar langsam einstellt, lässt sich Kohlenstoffmonoxid trotz der ungünstigen Gleichgewichtslage isolieren – Kohlenstoffmonoxid ist metastabil. Bei höheren Temperaturen verschiebt sich das Gleichgewicht zugunsten des Kohlenstoffmonoxids (Prinzip von Le Chatelier). Dies wird beispielsweise bei der Eisenherstellung im Hochofenprozess genutzt, wo das gasförmige Kohlenstoffmonoxid ein viel effektiveres Reduktionsmittel darstellt als fester Koks. In industriellen Prozessen führt Kohlenstoffmonoxid gegebenenfalls zur Vergiftung von Katalysatoren, da es stark an aktive Metallzentren wie Nickel- oder Eisenatome bindet und diese für andere Reaktanden blockiert.
Kohlenstoffmonoxid ist ein gutes und preiswertes Reduktionsmittel und wird in dieser Funktion vielfältig verwendet. Die Oxidationskraft ist hingegen nur schwach ausgeprägt. In der metallorganischen Chemie ist Kohlenstoffmonoxid ein häufig verwendeter einzähniger Ligand, die Chemie der Metallcarbonyle ist gut erforscht. Es zählt zu den Starkfeld-Liganden und ist isoelektronisch zum Stickstoff (N2) sowie zu den Ionen Cyanid (CN−) und Nitrosyl (NO+). Durch Ausprägung von sich synergetisch verstärkenden Hin- und Rückbindungen entsteht eine starke Metall-Ligand-Bindung. Kohlenstoffmonoxid ist ein starker σ-Donator und π-Akzeptor. Es migriert in Alkyl-Metall-Bindungen von Komplexen unter Bildung von Acylgruppen.
Mit Aromaten wie Benzol reagiert Kohlenstoffmonoxid mit Chlor unter Aluminiumchlorid- oder Kupfer(I)-chlorid-Katalyse in der Gattermann-Koch-Reaktion zu Benzaldehyd. Mit starken Reduktionsmitteln wie metallischem Kalium reagiert Kohlenstoffmonoxid zum Kaliumsalz des Hexahydroxybenzols beziehungsweise zum Kaliumsalz des Dihydroxyacetylens.
Verwendung
Kohlenstoffmonoxid wird in der chemischen Industrie häufig zusammen mit Wasserstoff als Synthesegas verwendet. Für einige Anwendungen wird jedoch auch reines Kohlenstoffmonoxid benötigt, etwa für die Herstellung von Metallcarbonylen wie Nickeltetracarbonyl oder Eisenpentacarbonyl, für Carbonylierungen oder die Herstellung von Koch-Säuren. Auch die Herstellung von Phosgen, Essigsäure und Essigsäureanhydrid und die Herstellung von Methylformiat und Ameisensäure benötigt reines Kohlenstoffmonoxid.
Reines Kohlenstoffmonoxid wird überwiegend durch physikalische oder chemische Abtrennungsverfahren aus Synthesegas erhalten. Die physikalische Abtrennung erfolgt durch partielle Kondensation und anschließender Destillation nach dem Linde-Verfahren oder durch Membranpermeation. Durch Adsorption unter Komplex-Bildung kann Kohlenstoffmonoxid mittels Kupfer(I)-Salzlösungen von anderen Bestandteilen des Synthesegases abgetrennt werden.
Das in der chemischen Industrie gebrauchte Kohlenstoffmonoxid wird meist vor Ort hergestellt und innerbetrieblich weiterverarbeitet. Daneben gibt es die Möglichkeit der Belieferung durch Tankwagen oder in Gasflaschen. Für die Vernetzung von Chemiestandorten ist die Verteilung durch Pipelines möglich. Projekte für den Neubau solcher Pipelines, etwa die CO-Pipeline der Bayer AG, stehen häufig in der Kritik und können zu langwierigen Verwaltungsgerichtsprozessen führen.
Synthesegasreaktionen
Methanolherstellung
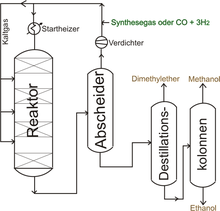
Methanol ist eine organische Grundchemikalie und ein mengenmäßig bedeutender großtechnisch hergestellter Alkohol. Die Herstellung aus Kohlenstoffmonoxid und Wasserstoff verläuft nach folgender Bruttogleichung:
Im Jahr 2008 betrug der weltweite Methanolverbrauch 45 Millionen Tonnen. Methanol wird heute großtechnisch aus Synthesegas im Nieder- oder Mitteldruckverfahren hergestellt. Das dabei entstehende Rohmethanol ist zum Teil mit Nebenprodukten verunreinigt. Wird das Rohmethanol im Energiesektor zur Verbrennung eingesetzt, ist die Reinheit des Rohmethanols ausreichend. Für die Weiterverarbeitung in der chemischen Industrie muss das Methanol destillativ aufgearbeitet werden. Leicht siedende Komponenten wie Dimethylether werden in einer Leichtsiederkolonne abgetrennt. Die höher siedenden Fraktionen werden als Sumpf in einer weiteren Destillationsstufe in einer Schwersiederkolonne abgetrennt, wobei Methanol über Kopf abgezogen wird.
Fischer-Tropsch-Synthese
In der Fischer-Tropsch-Synthese wird ein Kohlenstoffmonoxid-Wasserstoff-Gemisch mittels heterogener Katalyse umgesetzt. Die Katalysatoren basieren auf den Übergangsmetallen Cobalt, Eisen, Nickel und Ruthenium, als Träger finden poröse Metalloxide mit großen spezifischen Oberflächen wie Kieselgur, Aluminiumoxid, Zeolithe und Titandioxid Verwendung.
Das Gasgemisch wird in einer Aufbaureaktion zu Kohlenwasserstoffen wie Paraffinen, Olefinen und Alkoholen umgesetzt. Endprodukte sind Benzin (synthetisches Benzin), Diesel, Heizöl und Rohstoffe für die chemische Industrie. Die Reaktion findet bereits bei Atmosphärendruck und bei einer Temperatur von 160 bis 200 °C statt; technisch werden je nach Verfahren höhere Drücke und Temperaturen verwendet. Die Synthese verläuft nach folgendem Reaktionsschema:
(Alkane)
(n ≥ 2, Alkene)
(Alkohole)
Pro Kilogramm Kraftstoff entstehen etwa 1,25 Kilogramm Wasser, für dessen Herstellung etwa die Hälfte des eingesetzten Wasserstoffs verwendet wird. Das typische Fischer-Tropsch-Produkt enthält rund 10–15 % Flüssiggase (Propan und Butane), 50 % Benzin, 28 % Kerosin (Dieselöl), 6 % Weichparaffin (Paraffingatsch) und 2 % Hartparaffine. Das Verfahren ist für die großtechnische Produktion von Benzin und Ölen aus Kohle, Erdgas oder Biomasse von Bedeutung.
Hydroformylierung
Zusammen mit Wasserstoff wird Kohlenstoffmonoxid für die Hydroformylierung von Olefinen eingesetzt. Die entstehenden Produkte sind primär Aldehyde, wobei als Katalysatoren meist Metallcarbonylhydride in homogener oder heterogener Reaktion benutzt werden.
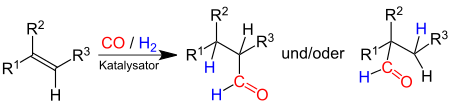
Ein technisch wichtiges Produkt der Hydroformylierung mit anschließender Hydrierung ist 2-Ethylhexanol. Aus 2-Ethylhexanol und Phthalsäureanhydrid kann der Weichmacher Di-n-octylphthalat hergestellt werden.
Reaktion mit organischen Molekülen und Wasser
Ameisensäure und Derivate
Reines Kohlenstoffmonoxid wird für die Herstellung von Ameisensäure aus Wasser und Methanol über eine Methylformiat-Stufe verwendet. Als Katalysator dient Natriummethanolat. Das im ersten Schritt verbrauchte Methanol wird im zweiten Schritt durch Hydrolyse wieder freigesetzt. Die erste Anlage dieser Art wurde 1981 in Betrieb genommen und produzierte 100.000 Tonnen pro Jahr. Im Jahr 2012 betrug die weltweite Produktionskapazität der BASF nach diesem Verfahren 255.000 Tonnen pro Jahr.
Mit Natriumhydroxid wird Natriumformiat erhalten, das als Grundstoff für die Oxalsäureherstellung dient.
Monsanto- und Tennessee-Eastman-Prozess
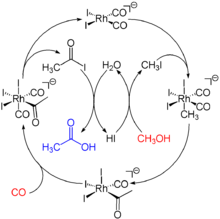
Durch Umsetzung von Kohlenstoffmonoxid mit Methanol mittels gemischter Rhodium-Carbonyle wird im Monsanto-Prozess Essigsäure erhalten. Diese wird weiter zu Vinyl- und Celluloseacetat sowie Zwischenprodukten der chemischen Industrie weiterverarbeitet.
Durch die Carbonylierung von Methylacetat im Tennessee-Eastman-Prozess bildet sich Essigsäureanhydrid.
Reppe-Chemie
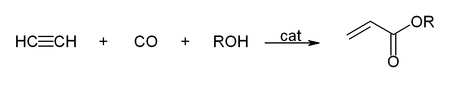
Kohlenstoffmonoxid wird für Carbonylierungsreaktionen in der organischen Synthese verwendet. Unter Reppe-Chemie wird das Arbeiten mit Acetylen unter erhöhtem Druck verstanden, wobei Metallcarbonyle und -carbonylwasserstoffe als Katalysator Verwendung finden. Eine wichtige Reaktion ist die Hydrocarboxylierung, bei der Acetylen mit Kohlenstoffmonoxid und Wasser beziehungsweise einem Alkohol zur Herstellung von Acrylsäure und Acrylsäureestern verwendet wird:
Koch-Säuren
Tertiäre Carbonsäuren, sogenannte Koch-Säuren, entstehen durch Koch-Reaktion von Kohlenstoffmonoxid mit Alkoholen oder Alkenen und Wasser unter Säurekatalyse bei hohen Drücken und erhöhter Temperatur.
Die chemische Industrie stellt pro Jahr etwa 150.000 Tonnen Koch-Säuren her. Einige häufig industriell hergestellte Koch-Säuren sind Pivalinsäure, 2,2-Dimethylbuttersäure und 2,2-Dimethylpentansäure.
Metallcarbonyle
Kohlenstoffmonoxid reagiert mit Übergangsmetallen zu Metallcarbonylen. Dabei handelt es sich um Komplexverbindungen, in denen Kohlenstoffmonoxid als Ligand fungiert. Die Metalle treten in diesen Verbindungen in der Oxidationszahl Null auf. Die Synthese des ersten homoleptischen Metallcarbonyl-Komplexes, des Nickeltetracarbonyls, gelang Ludwig Mond bereits 1890. In den darauffolgenden Jahren gelang die Synthese einer Reihe weiterer Metallcarbonyle wie Eisenpentacarbonyl, Dicobaltoctacarbonyl und Molybdänhexacarbonyl. In vielen Bereichen der metallorganischen Chemie nutzen Chemiker Metallcarbonyle als Schlüsselkomponenten, etwa zum Studium der chemischen Bindung und der gezielten Synthese metallorganischer Komplexe.
Die Metallcarbonyle finden weiterhin Verwendung in der organischen Synthese und als Katalysatoren oder Katalysatorvorstufen in der chemischen Industrie. Der Kohlenstoffmonoxidligand kann dazu durch andere, maßgeschneiderte Liganden, etwa das wasserlösliche Tris(natrium-meta-sulfonatophenyl)phosphan, ersetzt werden und damit gezielt an die Anforderungen technischer Prozesse, wie des Ruhrchemie/Rhône-Poulenc-Verfahrens. angepasst werden.
Phosgenherstellung
Phosgen wird unter katalytischem Einfluss von Aktivkohle aus Kohlenstoffmonoxid und Chlor hergestellt:
Phosgen ist ein wichtiger Ausgangsstoff für die Herstellung von Methylendiisocyanaten und Toluol-2,4-diisocyanat. Mit Diolen reagiert es unter Polykondensation zu Polycarbonaten.
Reduktionsmittel
Im Hochofen dient es als Reduktionsmittel für Eisenerz nach der Bruttoformel:
Das Kohlenstoffmonoxid wird nicht als Gas zugesetzt, sondern entsteht im Hochofen aus der Verbrennung von Koks und durch die nachfolgende Boudouard-Reaktion sowie über die Reaktion von heißem Koks mit Wasser unter Freisetzung von Kohlenstoffmonoxid und Wasserstoff. Durch die Reduktion der Eisenerze und der Oxide der Eisenbegleiter Mangan, Silicium und Phosphor wird Kohlenstoffmonoxid zum -dioxid oxidiert.
Das reduzierte Eisen nimmt aus dem Kohlenstoffmonoxid Kohlenstoff auf und wird zu Fe3C, dem sogenannten Zementit, wodurch der Schmelzpunkt von 1538 °C auf etwa 1300 bis 1400 °C sinkt.
In den dem Hochofen vorgeschalteten Winderhitzern wird das im Gichtgas enthaltene Kohlenstoffmonoxid verbrannt:
Mond-Prozess und Carbonyleisen

Das Mond-Verfahren verwendet Kohlenstoffmonoxid zur Reinigung des Metalls Nickel unter Bildung und Zerfall von Nickeltetracarbonyl in einer chemischen Transportreaktion. Das Verfahren wurde im Jahr 1890 von Ludwig Mond entwickelt. Der Prozess ist geeignet, um aus Nickeloxiden reines Nickelmetall herzustellen. Im ersten Schritt werden dazu die Oxide mit Wasserstoff zum Metall reduziert und danach bei 40 bis 60 °C mit Kohlenstoffmonoxid in das flüchtige Metallcarbonyl Nickeltetracarbonyl überführt. Dieses kann von den anderen Erzbestandteilen abdestilliert werden. Bei Temperaturen von 150 bis 300 °C zerfällt das Metallcarbonyl wieder in das reine Metall und Kohlenstoffmonoxid. Nach einem verwandten Verfahren lässt sich Carbonyleisen aus Eisenpentacarbonyl herstellen.
Lebensmitteltechnologie
Bei der Behandlung von Fleisch und Fisch lässt sich eine intensive rote Fleischfarbe durch die Behandlung mit niedrigen Konzentrationen von Kohlenstoffmonoxid erzielen. Durch die Bindung von Kohlenstoffmonoxid und Myoglobin entsteht ein kirschroter Carboxymyoglobinkomplex. Es wird dadurch optisch eine nicht mehr vorhandene Frische vorgetäuscht. Als Ersatzstoff wurde vom Basler Kantonslabor bei Thunfischen bereits der Einsatz von Nitrit nachgewiesen. Kohlenstoffmonoxid als Komponente einer Schutzgasverpackung ist in der Europäischen Union nicht zugelassen.
Energieträger
Mit aus Biomassevergasung hergestelltem Kohlenmonoxid können Generatoren, vor allem in Blockheizkraftwerken betrieben werden. Außerdem wurde Holzgas, welches zu großen Teilen aus Kohlenstoffmonoxid besteht eingesetzt, um Kraftfahrzeuge in Krisenzeiten zu Betreiben. Dabei wurden die Fahrzeuge mit Holzvergasern ausgestattet, und das Gas direkt dem Motor hinzu geführt. Vereinzelt soll dieses Verfahren noch heute eingesetzt werden.
Sonstige Verwendungen
Adsorbiertes Kohlenmonoxid findet vielfältige Verwendung in der Charakterisierung von heterogenen Kontakten und anderen Oberflächen. Neben der Bestimmung der Dispersion von aktiven Metallzentren über Chemisorption dienen Untersuchungen von adsorbiertem Kohlenstoffmonoxid mit oberflächensensitiven Methoden der industriellen und der Grundlagenforschung in der Halbleitertechnik, der Brennstoffzellen- und der Materialforschung. In der metallorganischen Chemie liefert die Untersuchung von Kohlenstoffmonoxidliganden mittels Infrarotspektroskopie vielfältige Informationen, etwa über die Bindungsmodi des Kohlenstoffmonoxids, die Komplexgeometrie und die Ladung des Komplexes. Bei heteroleptischen Metallcarbonylen liefert die Infrarotspektroskopie außerdem Informationen über die Eigenschaften und Bindungsverhältnisse des zum Kohlenstoffmonoxid trans-ständigen Liganden.
In Pelztierfarmen werden Kohlenstoffmonoxid und -dioxid zum Ersticken der Nerze verwendet, damit der Pelz möglichst wenig Schaden nimmt.
Stadtgas, das bei der Verkokung von Steinkohle anfiel, bestand zu etwa 9 bis 10 % aus Kohlenmonoxid. Pro Tonne Kohle wurden durch die Verkokung etwa 350 m³ Rohgas gewonnen. Dieses wurde nach der Gaswäsche in Gasometern gespeichert und mit Diphosphan odoriert, bevor es in das Gasnetz abgegeben wurde. Das Stadtgas wurde zunächst für die Straßenbeleuchtung mittels Gaslaternen benutzt, daher stammt der Name Leuchtgas. Etwa ab 1910 etablierte sich die Nutzung für Koch- und Heizzwecke in Privathäusern. In den 1970er Jahren wurde das Stadtgas weitgehend durch das ungiftige Erdgas ersetzt.
In der NS-Zeit wurde Kohlenstoffmonoxid bei Massentötungen der Aktion T4 im Rahmen der Euthanasie und „Tötung unwerten Lebens“ erstmals verwendet, bei denen vor allem psychisch kranke Menschen ermordet wurden. In einigen NS-Vernichtungslagern, beispielsweise im KZ Majdanek, wurde Kohlenstoffmonoxid später zur Massentötung in Gaskammern oder Gaswagen eingesetzt (entweder als Bestandteil von Verbrennungsmotorabgasen oder als reines CO aus Druckgasflaschen).
Toxizität
Allgemeines

Kohlenstoffmonoxid ist ein gefährliches Atemgift, da es leicht über die Lunge aufgenommen wird. Da das Gas farb-, geruch- und geschmacklos und nicht reizend ist, wird es kaum wahrgenommen. Das individuelle Toleranzlevel variiert. Im Laufe der Jahre kam es immer wieder zu spektakulären Unfällen mit Kohlenstoffmonoxid, etwa dem Eisenbahnunfall von Balvano (1944) oder dem Bergwerksunglück von Kellogg (1972), bei denen es zum Teil hunderte Todesfälle zu beklagen gab.
Wenn es über die Lunge in den Blutkreislauf gelangt ist, verbindet es sich mit dem zentralen Eisenatom des Hämoglobins und behindert so den Sauerstofftransport im Blut, was zum Tod durch Erstickung führen kann. Symptome einer leichten Vergiftung sind Kopfschmerzen, Schwindel und grippeähnliche Symptome. Höhere Dosen wirken signifikant toxisch auf das Zentralnervensystem und das Herz. Kohlenstoffmonoxid gilt als Ursache für mehr als die Hälfte aller tödlichen Vergiftungen weltweit. In den Vereinigten Staaten starben laut einer Studie zwischen 1979 und 1988 über 56.000 Menschen an einer Kohlenstoffmonoxidvergiftung, wobei in mehr als 25.000 Fällen die Vergiftung in Suizidabsicht erfolgte. Über 15.000 Fälle standen in Zusammenhang mit Bränden, und in mehr als 11.000 Fällen handelte es sich um unbeabsichtigte, nicht mit Bränden zusammenhängende Todesfälle. Die Zahl der unbeabsichtigten Vergiftungen durch Automobilabgase ist durch den verbreiteten Einsatz von Drei-Wege-Katalysatoren stark rückläufig. Dennoch führten nicht auf Feuer zurückzuführende Vergiftungen mit Kohlenstoffmonoxid in den USA im Jahr 2011 zu etwa 15.000 Behandlungen in Krankenhaus-Notaufnahmen und 500 Todesfällen. In Deutschland gibt es seit dem 1. August 1990 eine Meldepflicht für Kohlenstoffmonoxidvergiftungen. Von diesem Stichtag bis zum 31. Dezember 2008 wurden dem Bundesinstitut für Risikobewertung über 57.000 ärztliche Mitteilungen zu Vergiftungen oder Verdachtsfällen gemeldet, also etwa 3000 pro Jahr.
Wirkung
.jpg)
Der prozentuale Anteil des im Blut mit Kohlenstoffmonoxid belegten Hämoglobins wird auch als COHb abgekürzt (Kohlenstoffmonoxid-Hämoglobin). Für gesunde Erwachsene besteht nach älteren Studien auch bei Dauerbelastung von acht Stunden täglich bei Konzentrationen bis 115 ppm keine Gefahr; es entstehen lediglich Konzentrationen von 4 % COHb bei Nichtrauchern und 7,6 % bei Rauchern. Neuere Studien belegen jedoch, dass bei Risikogruppen mit Herz-Kreislauf-Erkrankungen schon Belastungen ab 2,7 % Krankheitssymptome verstärken können. Bei höheren chronischen Belastungen über 150 bis 300 ppm entstehen Schwindelgefühle, Schläfrigkeit, Übelkeit und Erbrechen. Zu akut tödlich wirkenden Mengen des Gases (LC50) siehe Infobox (oben). Schwerhörigkeit wird bei CO-Belastung um bis zu 50 % verstärkt. Andere Quellen, die sich auf neuere Studien beziehen, gehen jedoch davon aus, dass bereits Werte von 2–5 % COHb zu ersten Symptomen führen. Zum Beispiel stören schon, kaum merklich, 2 % COHb die Zeitempfindung. Bei COHb-Werten von unter 20 % treten Müdigkeit, Kopfschmerzen, Herzrasen und Sehstörungen auf. Im Bereich von 20 bis 30 % sind Symptome wie Benommenheit, Schwindel und Muskelschwäche bekannt. Im Bereich von 30 bis 50 % COHb treten Übelkeit, Erbrechen, Konzentrationsstörungen, Ohrensausen, Bewusstseinsverlust und Kreislaufkollaps auf. Die Haut färbt sich rosa. Ab einem COHb-Wert von 50 % tritt eine tiefe Bewusstlosigkeit ein, begleitet von Krämpfen und Atemstörungen. Es herrscht dann akute Lebensgefahr. Der Tod tritt ein bei COHb-Werten von 60 bis 70 %. Etwa 85 % des eingeatmeten Kohlenstoffmonoxids sind im Blut gebunden, die restlichen 15 % sind im Myoglobin als kirschrotes Carboxymyoglobin gebunden.
Die individuelle Kohlenstoffmonoxidtoleranz wird durch verschiedene Faktoren beeinflusst, wie die ausgeführte Tätigkeit, die Atemfrequenz, Vorschädigungen oder Erkrankungen (Blutkreislauf, Anämie oder Sichelzellenanämie). Andere Faktoren sind der Atmosphärendruck oder der Grundumsatz.
Kohlenstoffmonoxid bindet etwa 250 bis 325-mal stärker an den roten Blutfarbstoff Hämoglobin als Sauerstoff, bei einem Kohlenstoffmonoxidanteil von 0,1 % in der Atemluft wird also etwa die Hälfte der roten Blutkörperchen deaktiviert. Die Giftwirkung des Kohlenstoffmonoxids wird durch die Proteinumgebung des Häms im Hämoglobin gemindert, so bindet Kohlenstoffmonoxid an ein ungehindertes Häm etwa 26.000-mal stärker als Sauerstoff. Als Ursache wird angenommen, dass in der Enzymtasche zu wenig Platz ist, um die vom Kohlenstoffmonoxid bevorzugte lineare Fe-C-O-Geometrie zu erlauben, die vom Disauerstoff bevorzugte gewinkelte Koordination wird dagegen nicht behindert. Bei einem Atemluftanteil von etwa 0,5 Vol.-% tritt der Tod binnen weniger Minuten ein. Die Eliminationshalbwertszeit des Kohlenstoffmonoxids aus dem Blut beträgt 2 bis 6,5 Stunden, abhängig von der aufgenommenen Menge an Kohlenstoffmonoxid und der Ventilationsrate des betroffenen Menschen.
Folgeschäden
Neben der akuten Vergiftung zeigen sich Folgeschäden. Kohlenstoffmonoxid hat schwerwiegende negative Effekte auf die Fötenentwicklung. Chronische Exposition niedriger Kohlenstoffmonoxidkonzentrationen kann zu Depressionen führen. Im Mittel gelten Belastungen von mehr als 100 ppm als gesundheitsgefährdend. Als Arbeitsplatzgrenzwert (AGW – früher: MAK-Wert) gelten 30 ppm. Kohlenstoffmonoxid kann durch Herzschädigung die Lebenserwartung mindern. Eine beruflich bedingte Kohlenstoffmonoxidvergiftung ist als Berufskrankheit anerkannt. Zwischen 2005 und 2008 wurden laut den Berichten des Bundesministeriums für Arbeit und Soziales etwa 126 Erkrankungen durch Kohlenstoffmonoxid pro Jahr gemeldet.
2021 hat die Weltgesundheitsorganisation ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Kohlenstoffmonoxid liegt bei 4 mg/m3 im 24-Stunden-Mittel.
Diagnostik
Durch die Bindung des Kohlenstoffmonoxids an Hämoglobin werden konventionelle Pulsoxymeter getäuscht und geben fälschlich hohe Sauerstoffsättigungsraten an. Mit neueren 7-Wellenlängen-Pulsoxymetern kann jedoch auch der CO-gesättigte Anteil des Hämoglobins detektiert werden. Die äußerlichen Anzeichen einer Kohlenstoffmonoxidvergiftung sind kirschrote Schleimhäute. Nach neueren Untersuchungen mit hohen Fallzahlen (231 Patienten) ist dieses klinische Zeichen insbesondere bei leichteren Vergiftungsformen selten anzutreffen. Die Farbe ist ein Resultat der tiefroten Hämoglobin-Kohlenstoffmonoxid-Charge-Transfer-Komplexe. Ferner können die nach dem Tod bei der Leiche auftretenden Totenflecke (Livores) durch diesen Mechanismus ebenfalls leuchtend rot gefärbt sein und somit einen Hinweis auf eine Kohlenstoffmonoxidvergiftung geben.
Therapie
Patienten mit einer ausgeprägten Kohlenstoffmonoxidvergiftung werden im Allgemeinen intubiert und mit positiv endexpiratorischem Druck (PEEP) und 100 % Sauerstoff beatmet. Durch das deutlich erhöhte Sauerstoffangebot wird das Kohlenstoffmonoxid vom Hämoglobin verdrängt. Auch eine hyperbare Oxygenierung kann erwogen werden.
Die Halbwertszeit, mit der die erhöhte CO-Konzentration im Blut (CO-Hb-Wert) durch Abatmen in Frischluft sinkt, beträgt etwa 3–8 Stunden. Die Halbwertszeit kann durch forcierte Sauerstofftherapie (Hyperventilation mit reinem Sauerstoff mittels orotrachealer Intubation) auf bis zu 45 Minuten gesenkt werden.
Biologische Bedeutung
Mensch
Beim Menschen liegt der Anteil des im Blut mit Kohlenstoffmonoxid belegten Hämoglobins COHb im venösen Blut zwischen 0,7 und 1,1 %, wovon etwa 0,5 % endogen produziert werden. Ein erhöhter Kohlenstoffmonoxid-Spiegel in den Zellen führt zur bis zu 1000-fach verstärkten Ausschüttung des Glykoproteins Erythropoetin (EPO).
Botenstoff
Das Enzym Hämoxygenase baut Häm-Verbindungen, die vorwiegend aus Hämoglobin stammen, unter Freisetzung von Kohlenstoffmonoxid ab. Dieses Enzym sowie eine Guanylatcyclase, die von Kohlenstoffmonoxid reguliert wird, konnten im Geruchszentrum des menschlichen Gehirns und im Bulbus olfactorius nachgewiesen werden. Demnach könnte Kohlenstoffmonoxid als gasförmiger Botenstoff für den Geruchssinn dienen. Die aktivierte Guanylatcyclase setzt den sekundären Botenstoff cGMP frei. Neben Kohlenstoffmonoxid, cGMP und cAMP wird auch Stickstoffmonoxid als Second Messenger betrachtet. Sowohl Stickstoff- als auch Kohlenstoffmonoxid können als extrem niedermolekulare, wasserlösliche Gase sehr schnell und relativ unbehindert Biomembranen durchdringen und dienen deshalb als Neurotransmitter bei der Übertragung von Informationen aus dem primären oder sensorischen in das sekundäre oder Langzeitgedächtnis durch das limbische System.
Entzündungshemmende Eigenschaften
Kohlenstoffmonoxid besitzt bei chronischer Darmentzündung eine entzündungshemmende Wirkung, was die vorher rätselhafte Tatsache erklärt, dass Raucher wesentlich seltener an Colitis ulcerosa erkranken als Nichtraucher. Auch nach Lungentransplantationen verhindert eine inhalative, gering dosierte Gabe von Kohlenstoffmonoxid einen Schaden durch Ischämie oder Reperfusion. Werden Nieren, die zur Transplantation vorgesehen sind, in einer Lösung aufbewahrt, die Kohlenstoffmonoxid in geringer Konzentration enthält, wird der ansonsten zu beobachtende Anstieg an freiem Häm und Abfall an Cytochrom P450 gehemmt und so eine zellschädigende Lipidperoxidation vermindert. Günstige Wirkungen von Kohlenstoffmonoxid wurden zudem beschrieben in Tiermodellen von septischem Schock, Darmverschluss (Ileus) und Arteriosklerose. Bei Frauen mit Schwangerschaftshypertonie und Schwangerschaftsvergiftung (Präeklampsie) ist die Kohlenstoffmonoxidkonzentration in der Ausatemluft vermindert. Raucherinnen haben ein vermindertes Risiko, an Präeklampsie zu erkranken. Medikamente, die kontrollierte Mengen an Kohlenstoffmonoxid transportieren und freisetzen können, befinden sich in der Entwicklung.
Anaerobe Atmung bei Archaeen
In der Methanbildung (Methanogenese) wird Kohlenstoffmonoxid von wenigen Archaeen als Substrat für die anaerobe Atmung verwendet. So bilden Methanothermobacter thermautotrophicus und Methanosarcina barkeri aus vier Molekülen CO und zwei Molekülen Wasser drei Moleküle CO2 und ein Molekül Methan, gemäß:
Auch Methanosarcina acetivorans kann CO als Substrat verwenden, wobei parallel Acetat und Formiat gebildet werden. Diese Art der Acetogenese in Methanogenen bezeichnet man als carboxidotrophe Acetogenese.
Energie- und Kohlenstoffquelle kohlenstoffmonoxidverwertender Bakterien
| Physiologische Gruppe (nicht alle können mit CO wachsen, grün: aerob, rot: anaerob) | untersuchter Vertreter | Reaktionsgleichung |
|---|---|---|
| Carboxidotrophe Bakterien | Oligotropha carboxidovorans | 2 CO + O2 → 2 CO2 |
| Hydrogenogene Bakterien | Carboxydothermus hydrogenoformans | CO + H2O → CO2 + H2 |
| Acetogene Bakterien | Moorella
thermoacetica (früher als Clostridium thermoaceticum bezeichnet) |
4 CO + 2 H2O → CH3COOH + 2 CO2 |
| Phototrophe Bakterien | Rhodospirillum
rubrum |
CO + H2O → CO2 + H2 |
| Sulfidogene Bakterien | Desulfovibrio vulgaris | 4 CO + H2SO4 → 4 CO2 + H2S |
Nur wenige Bakterien vermögen Kohlenstoffmonoxid als Substrat zu verwenden. Dies nutzen sie zum Aufbau organischer Verbindungen (Kohlenstoffdioxid-Assimilation) und zur Energieerzeugung. Zu den kohlenstoffmonoxidverwertenden Bakterien zählen die aerob lebenden Carboxidobakterien. Sie sind fakultativ chemolithoautotroph, was bedeutet, dass sie von der Oxidation anorganischer Stoffe leben. Carboxidobakterien oxidieren Kohlenstoffmonoxid in Anwesenheit von Sauerstoff zu Kohlenstoffdioxid, gemäß:
Alternativ können einige Arten auch anstatt Sauerstoff Nitrat (NO3−) verwenden (Denitrifikation), dies geschieht unter Ausschluss von Sauerstoff (anaerob). Ein gut untersuchter aerober CO-Oxidierer ist Oligotropha carboxidovorans. Carboxidobakterien wirken damit wahrscheinlich der Luftverschmutzung der Atmosphäre mit CO entgegen.
Daneben gibt es eine Reihe von strikt anaerob lebenden Chemolitotrophen, die CO unter Abwesenheit von Sauerstoff oxidieren. So geschieht dies bei Carboxydothermus hydrogenoformans gemäß:
Schlüsselenzym in beiden Arten ist eine Kohlenmonoxid-Dehydrogenase (CODH). Die aerobe CODH enthält Kupfer und Molybdän, während die CODH der strikt anaeroben Bakterien Eisen und Nickel nutzt.
Nachweis

Es sind mehrere Arten von Kohlenstoffmonoxidsensoren bekannt. Sie basieren auf optochemischer Detektion, Infrarot- oder Wärmeleitfähigkeitmessung, Wärmetönungsmessung, elektrochemischen Vorgängen oder auf Halbleiterbasis. Das einfachste Konstruktionsprinzip verwendet optochemische Substanzen, die beim Kontakt mit Kohlenstoffmonoxid ihre Farbe verändern. Die Sensoren sind einfach und preiswert, die Anzeige des Kohlenstoffmonoxids erfolgt jedoch eher qualitativ. Als optochemische Anzeige dient etwa die Bildung von Metallcarbonylen. Eine genauere Messung der Kohlenstoffmonoxidkonzentration gelingt mit elektrochemischen Sensoren oder Sensoren auf Halbleiterbasis. Weit verbreitet sind nichtdispersive Infrarotsensoren. Im Handel gibt es heute tragbare und stationäre elektronische Sensoren (Gaswarngeräte), die den Nachweis von Kohlenstoffmonoxid im Bereich von 20 bis 2000 ppm in der Raumluft gestatten. Ein Alarm erfolgt meist aufgrund einer Konzentration-Zeit-Funktion, damit Fehlalarme, etwa durch Zigarettenrauch, möglichst unterbleiben.
Als präzises Nachweisreagenz dient auch Diiodpentoxid I2O5, das in einem U-Rohr bei höheren Temperaturen (etwa 80–160 °C) in Gegenwart von Kohlenstoffmonoxid quantitativ zu elementarem Iod I2 reduziert wird, bei gleichzeitiger Bildung von Kohlenstoffdioxid CO2:
Der Farbumschlag eignet sich auch für den Nachweis mittels Prüfröhrchen. Durch Rück-Titration des Iods mit Thiosulfat S2O32− (Iodometrie) lässt sich der CO-Gehalt des Gases bestimmen. Alfred Ditte erforschte schon im Jahr 1870 dieses Verfahren mit Diiodpentoxid. Wasserstoff – auch in höheren Konzentrationen – stört dabei nur sehr minimal die Nachweisgenauigkeit dieser Methode. Durch gleichzeitige quantitative Bestimmung des umgesetzten Kohlenstoffdioxids (Bestimmung durch Leitfähigkeit oder durch Fällung einer Bariumhydroxidlösung) ist die Messung sehr genau.
Bereits bei Raumtemperatur reagiert Kohlenstoffmonoxid mit wässrigen Palladiumsalz-Lösungen. Dabei werden Pd2+-Salze zum metallischen Palladium reduziert, wobei Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidiert wird. Das Ausfällen des feinverteilten metallischen Palladiums färbt die Probelösung dunkel und zeigt damit Kohlenstoffmonoxid an.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.12. 2025