Redlich-Kwong-Zustandsgleichung
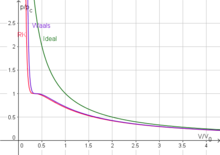
Die Redlich-Kwong-Zustandsgleichung ist eine Zustandsgleichung für reale Gase, die 1949 von Otto Redlich und Joseph Neng Shun Kwong gefunden wurde. Sie verbessert die Van-der-Waals-Gleichung nur unwesentlich, ist jedoch aufgrund ihrer vergleichsweise einfachen Form auch heute noch von Interesse.
Weiterentwicklungen sind die Soave-Redlich-Kwong-Zustandsgleichung und die PSRK-Zustandsgleichung.
Formulierung
Die Redlich-Kwong-Zustandsgleichung lautet:
mit
- Kohäsionsdruck
- Kovolumen
– molares Volumen
– Temperatur
– kritische Temperatur
– Druck
– kritischer Druck
– universelle Gaskonstante.
Mit den reduzierten
Zustandsgrößen
lässt sich die Zustandsgleichung in der reduzierten Form schreiben:
mit .
Anwendungsbereich
Die Redlich-Kwong-Gleichung eignet sich für die Berechnung in Gasphasen, wenn das Verhältnis von Druck zu kritischem Druck kleiner ist als die Hälfte des Verhältnisses von Temperatur zu kritischer Temperatur.:
Gleichbedeutend: der reduzierte
Druck darf maximal die halbe Größe der reduzierten
Temperatur
besitzen:
Eine schlechte Näherung zeigt sich für flüssige Phasen, weshalb die Gleichung nicht für Gas-Flüssigkeits-Gleichgewichte herangezogen werden kann. Dieser Nachteil kann jedoch durch die separate Nutzung besser angepasster Gleichungen ausgeglichen werden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.07. 2020