
Kohlenstoffgruppe
| Gruppe | 14 |
| Hauptgruppe | 4 |
| Periode | |
| 2 | 6 C |
| 3 | 14 Si |
| 4 | 32 Ge |
| 5 | 50 Sn |
| 6 | 82 Pb |
| 7 | 114 Fl |
Kohlenstoffgruppe oder Kohlenstoff-Silicium-Gruppe bezeichnet die 4. Hauptgruppe („Tetrele“, selten auch "Tattogene" (Gerüstbildner)) (nach neuer Nummerierung der IUPAC Gruppe 14) des Periodensystems. Sie umfasst die Elemente Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Auch ein radioaktives Element, das Flerovium (Fl), ist vertreten.
-
 Graphit
Graphit -
 Diamanten
Diamanten -
C60-Fulleren
-
 hochreines Silicium
hochreines Silicium -
 Siliciumpulver
Siliciumpulver -
 Germanium
Germanium -
 α und β Zinn
α und β Zinn -
 Blei
Blei
Eigenschaften
Die Elemente der Kohlenstoffgruppe weisen sehr unterschiedliche chemische und physikalische Eigenschaften auf, weil die Gruppe durch die Trennlinie zwischen Metallen und Nichtmetallen in zwei Teile gespalten wird. Das erste Element der Gruppe, Kohlenstoff, ist ein Nichtmetall, die beiden folgenden (Silicium und Germanium) sind Halbmetalle und alle weiteren (Zinn, Blei und Flerovium) sind Metalle.
Physikalische Eigenschaften
Mit zunehmender Ordnungszahl wachsen Atommasse, Atomradius und Ionenradius. Die Dichte von Graphit (C) und Silicium liegen dicht beieinander (ca. 2,3 kg/dm3), sie steigt innerhalb der Hauptgruppe bis zum Blei auf 11,34 kg/dm3 an. Bei der Mohshärte gibt es ebenfalls eine große Spannweite, die von maximal 10 bei Diamant bis zu minimal 1,5 bei Zinn reicht. Die höchste elektrische Leitfähigkeit hat Zinn mit 9,17 MS/m, die geringste weist Silicium mit 25,2 mS/m auf. Die 1. Ionisierungsenergie sinkt mit wachsender Ordnungszahl von 11,26 eV bei Kohlenstoff auf 7,34 eV bei Zinn ab. Blei hat mit 7,42 eV wieder einen leicht erhöhten Wert. Die Elektronegativität fällt mit steigender Ordnungszahl von 2,5 (C) bis 1,6 (Pb) tendenziell ab, Ausreißer mit 1,7 ist das Silicium.
| Element | Atommasse | Schmelzpunkt (K) |
Siedepunkt (K) |
Dichte (kg/m3) |
Mohshärte | Elektr. Leitfähigkeit (S/m) |
Elektronegativität |
|---|---|---|---|---|---|---|---|
| Kohlenstoff | 12,011 | 3823 | 5100 | 2250 bis 3510 | 0,5 bis 10,0 | 10−4...10+6,5 | 2,5 |
| Silicium | 28,086 | 1683 | 2628 | 2330 | 6,5 | 2,52 · 10−4 | 1,7 |
| Germanium | 72,59 | 1211 | 3093 | 5323 | 6 | 1,45 | 2,0 |
| Zinn | 118,71 | 505 | 2875 | 7310 | 1,5 | 9,17 · 106 | 1,96 |
| Blei | 207,2 | 601 | 2022 | 11340 | 1,5 | 4,81 · 106 | 1,6 |
Elektronenkonfiguration
Die Elektronenkonfiguration lautet [X] ys2yp2. Das X steht hierbei für die Elektronenkonfiguration des eine Periode höher stehenden Edelgases, und für das y muss die Periode eingesetzt werden, in der sich das Element befindet. Ab Germanium ist auch ein (y−1)d10-Orbital vorhanden; und ab Blei findet sich auch ein (y−2)f14-Orbital.
Für die einzelnen Elemente lauten die Elektronenkonfigurationen:
- Kohlenstoff: [ He ] 2s22p2
- Silicium: [ Ne ] 3s23p2
- Germanium: [ Ar ] 3d104s24p2
- Zinn: [ Kr ] 4d105s25p2
- Blei: [ Xe ] 4f145d106s26p2
- Flerovium (berechnet): [ Rn ] 5f146d107s27p2
Die Oxidationszustände sind +4 und −4, mit steigender Ordnungszahl gewinnt jedoch auch die Oxidationsstufe +2 an Bedeutung.
Chemische Reaktionen
Aufgrund der großen Unterschiede innerhalb der Gruppe lässt sich nur schwer ein allgemeines Reaktionsverhalten angeben, da dieses von Element zu Element variiert. In den folgenden Gleichungen steht das E für ein Element aus der Kohlenstoffgruppe.
- Reaktion mit Sauerstoff:
- Die wichtigste Reaktion ist die Bildung des jeweiligen Dioxids aus den Elementen.
- Neben den vierwertigen Oxiden sind aber von allen Gruppenelementen auch die zweiwertigen Oxide bekannt. Die Stabilität der zweiwertigen Oxide nimmt dabei mit steigender Ordnungszahl zu, die der vierwertigen Oxide nimmt etwas ab. Daneben sind noch verschiedene Sub- und Mischoxide bekannt, wie z.B. das Kohlenstoffsuboxid C3O2 oder das Blei(II,IV)-oxid Pb3O4.
- Reaktion mit Wasserstoff (ohne Kettenbildung, nicht spontan):
- Reaktion mit Wasser:
- Keines der Gruppenelemente reagiert mit Wasser.
- Kohlenstoff, Silicium und Germanium reagieren nur zum Tetrachlorid, bei Zinn sind SnCl4 und SnCl2 möglich und Blei bildet nur das Dichlorid PbCl2.
Kettenbildung
Eine Besonderheit der Gruppe-14-Elemente ist ihre Fähigkeit, langkettige Wasserstoffverbindungen der Struktur XH3-(XH2)n-XH3 zu bilden. Alle Wasserstoffatome sind kovalent gebunden, die Stabilität dieser Verbindungen nimmt jedoch mit steigender Ordnungszahl des Elementes ab.
- Kohlenwasserstoffe: Die Gruppe der Kohlenwasserstoffe ist die umfangreichste, da der Zahl der C-Atome und somit auch der Kettenlänge kaum Grenzen gesetzt sind. Eine weitere spezifische Eigenschaft des Kohlenstoffs ist die Fähigkeit zur Ausbildung stabiler Doppel- und Dreifachbindungen. Mit den Kohlenwasserstoffen und deren Derivaten beschäftigt sich die Organische Chemie.
- Silane: Bei Silicium ist die Fähigkeit zur Kettenbildung bereits auf maximal 15 Si-Si –Bindungen beschränkt. Doppel- oder gar Dreifachbindungen sind bei Silicium und den folgenden Elementen instabil, doch auch die Silane zählen nicht zu den stabilsten Verbindungen.
- Germane: Germanium ist nur noch zu maximal neun Ge-Ge –Bindungen fähig. Das schränkt die Möglichkeiten natürlich stark ein.
- Zinnwasserstoffe: Bei Zinn ist nur noch eine einzige Sn-Sn-Bindung möglich. Es gibt daher auch nur zwei Verbindungen dieser Klasse: SnH4 und SnH3-SnH3.
- Bleiwasserstoff: Blei besitzt nicht die Fähigkeit zur Kettenbildung. Nur PbH4 ist bekannt, doch auch diese Verbindung ist beinahe instabil.
Auch Ringbildungen sind möglich, die Summenformel lautet dann (XH2)n.
Verbindungen
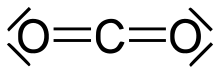
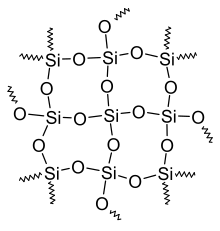
- Oxide (IV), Hydroxide und Säuren
- Kohlenstoffdioxid (CO2) ist aufgrund der Stabilität der C=O–Doppelbindung ein dreiatomiges, linear gebautes und daher unpolares Molekül und liegt im gasförmigen Aggregatzustand vor. In Wasser bildet es die unbeständige, schwache Kohlensäure (H2CO3).
- Im Siliciumdioxid (SiO2) existieren ausschließlich Einfachbindungen. Es ist ein Feststoff und besteht aus SiO4-Tetraedern, die über alle Ecken miteinander verknüpft sind. In der Natur tritt SiO2 als Quarz auf. Amorphes SiO2 (Kieselglas) ist der wesentliche Bestandteil von Glas.
- Germaniumdioxid (GeO2) entspricht im Wesentlichen dem Siliciumdioxid, kann aber auch in der Rutil-Struktur kristallisieren. Letzteres bildet mit Wasser die Germaniumsäure (H4GeO4).
- Zinn(IV)-oxid (SnO2) ist ein Feststoff und nicht löslich in Wasser.
- Blei(IV)-oxid (PbO2) ist ebenfalls ein in Wasser unlöslicher Feststoff.
- Wasserstoffverbindungen: siehe unter Kettenbildung
- sonstige:
- Kohlenstoffmonoxid (CO) ist ein giftiges Gas.
- Siliciummonoxid (SiO) ist ein dunkelbrauner, amorpher Feststoff aus polymeren (SiO)x-Ketten.
- Silikone bestehen aus dreidimensionalen Netzwerken aus abwechselnd Silicium und Sauerstoff, wobei sich an den Siliciumatomen meistens organische Reste (zum Beispiel Methylgruppen (-CH3)) befinden.
- Blei(II)-oxid
- Blei(II,IV)-oxid
Vorkommen


Die Erdkruste besteht zu 27,7 % aus Elementen der Kohlenstoffgruppe. Davon entfallen 99,8 % auf Silicium, das zweithäufigste Element in der Erdkruste (nach Sauerstoff).
Die übrigen 0,2 % teilen sich wie folgt auf:
- 99,1 % Kohlenstoff
- 0,94 % Blei
- 0,02 % Zinn
- 0,01 % Germanium
Mit Ausnahme von Germanium treten sie unter natürlichen Bedingungen auch in gediegener Form auf.
Literatur
- Hans Breuer: dtv-Atlas Chemie (Band 1: Allgemeine und anorganische Chemie). S. 131–153 (2000), ISBN 3-423-03217-0


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.10. 2025